
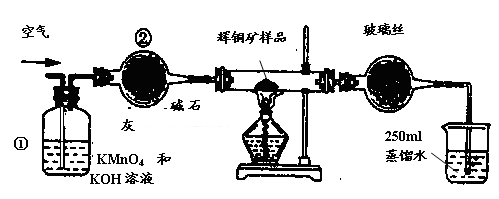
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接全部仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(1)除去空气中的还原性气体与酸性气体; 干燥空气
(2)2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O
滴入最后一滴标准KMnO4溶液后,溶液由无色变为淡紫色,并在半分钟内不褪色
(3)80%
(4)在KMnO4滴定前,未反应完的SO2与空气中的O2也可将H2SO3氧化,造成测定结果偏低
(5)4 ×10-3mol/L
解析试题分析:(1)装置①溶液含有KMnO4具有氧化性,可吸收空气中的还原性气体,NaOH可吸收酸性气体;装置②含有碱石灰,具有吸水性,可干燥空气。
(2)操作F中KMnO4氧化H2SO4,配平可得化学方程式:2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O;滴定达到终点时,H2SO3完全反应,所以现象为:滴入最后一滴标准KMnO4溶液后,溶液由无色变为淡紫色,并在半分钟内不褪色。
(3)三次滴定标准液的体积分别为:19.99mL、20.01mL、18.04mL,第三次滴定的体积差别较大,数据出现了错误,应舍去,前两次滴定标准液的平均体积为20.00mL,根据化学方程式可得物质的对应关系为:5Cu2S ~ 5SO2~ 5H2SO3~ 2KMnO4,则辉铜矿样品中Cu2S的质量分数="0.02L×0.0100mol/L×5/2×10×160g/mol÷1.000g×100%" =80%
(4)SO2能被空气中的O2氧化,所以在KMnO4滴定前,未反应完的SO2与空气中的O2也可将H2SO3氧化,造成测定结果偏低。
(5)(Fe2+)为 lmol/L,则c(S2-) = Ksp(FeS)÷c(Fe2+)=" 6" . 25 × 10 -18÷1="6" . 25 × 10 -18,带入c2 (H+) ·c(S2-) =" 1" . 0×10-22,可得c(H+)="4" ×10-3mol/L
考点:本题考查实验方案的分析、化学计算。


科目:高中化学 来源: 题型:填空题
以食盐为原料进行生产并综合利用的某些过程如下图所示: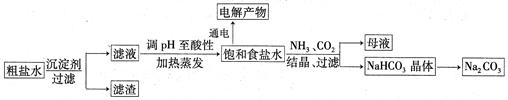
(1)为除去粗盐中的Ca2+、Mg2+和SO ,得到纯净的NaCl晶体,需加入以下试剂:
,得到纯净的NaCl晶体,需加入以下试剂:
| A.过量的NaOH溶液; | B.过量的Na2CO3溶液; | C.适量的盐酸; | D.过量的BaCl2溶液。 |
 (OH-)的比值是_________。
(OH-)的比值是_________。查看答案和解析>>
科目:高中化学 来源: 题型:问答题
根据Fe3++ Ag  Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
(1)FeCl3溶液显酸性,原因是 (用离子方程式表示)。
(2)关于FeCl3溶液洗银后的相关叙述正确的是 (填序号)。
a.c(Fe3+)减小 b.c(Cl-)不变 c.铁元素质量减小
(3)Fe(NO3)3溶液洗银时,甲同学认为NO3-也能将银氧化。他认为可以通过检验Fe(NO3)3溶液洗银后NO3-的还原产物来判断NO3-是否能将银氧化,而乙同学认为此方法不 可行,乙同学的理由是 。
(4)乙同学欲从洗银废液(Fe3+、 Fe2+、 Ag+、 NO3-)中回收银和刻蚀液,设计了如下路线:
①过程Ⅰ中反应的离子方程式是 。
②过程Ⅱ中加入的试剂可以是 。
(5)镀银后的银氨溶液放置时会析出有强爆炸性的物质,所以不能贮存。从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①生成AgCl沉淀的化学方程式是 。
②若该反应中消耗3.3 g羟氨,理论上可得银的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示: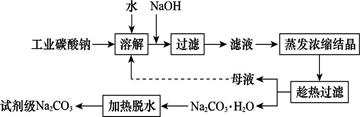
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(0H)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
 ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1 ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |



查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(7分)用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3 g烧碱样品配制成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还必须用到的仪器有 。
(2)取待测液10.00 mL,用 滴定管量取,并置于锥形瓶中。
(3)向锥形瓶中滴加几滴指示剂,用0.200 mol·L-1标准盐酸滴定待测烧碱溶液。不适宜选用的指示剂为(选填序号):________。①石蕊试液 ②无色酚酞 ③甲基橙试液
(4)根据两次滴定获得的实验数据如下表,得出烧碱的纯度为 。
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是 (填编号),该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为________色, 且半分钟内不变色。
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度为 mol/L。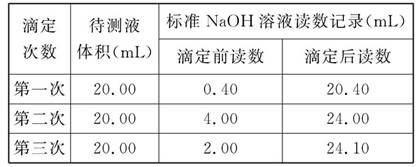
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂。请填写下列空白:
(1)碱式滴定管的使用方法,正确步骤的先后顺序为(填选项符号):
A.用氢氧化钠溶液润洗仪器并加入氢氧化钠溶液
B.放出氢氧化钠溶液进行滴定
C.调节起始读数
D.查漏,再水洗2-3遍
(2)用标准的NaOH溶液滴定待测的盐酸时,左手控制碱式滴定管的玻璃球,右手摇动锥形瓶,眼睛应注视 ;
(3)若滴定开始和结束时,碱式滴定管中的液面如上图所示:则所用NaOH溶液的体积为 mL。
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测盐酸的体积/mL | 0.1000 mol/LNaOH溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 2.00 | 28.15 | 26.15 |
| 第二次 | 25.00 | 1.50 | 29.50 | 28.00 |
| 第三次 | 25.00 | 0.20 | 26.55 | 26.35 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com