
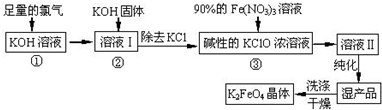
分析 足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH固体,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下次氯酸根离子才能和铁离子发生氧化还原反应生成高铁酸根离子,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4,
(1)K2FeO4具有强氧化性,可杀菌消毒,同时被还原形成Fe(OH)3胶体,可吸附水中悬浮物形成沉淀;
(2)由工艺流程可知,反应①足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O;
(3)由工艺流程可知,反应液I中有过量的Cl2反应,生成更多的KClO;
(4)根据溶液Ⅱ中分离K2FeO4后,还有副产品KNO3、KCl,则Fe(NO3)3溶液与碱性KClO溶液反应生成高铁酸钾和KNO3、KCl,利用得失电子守恒可写出离子方程式;
(5)检验最后一次的洗涤中无Cl-即可.
解答 解:(1)K2FeO4具有强氧化性,可杀菌消毒,同时被还原形成Fe(OH)3胶体,可吸附水中悬浮物形成沉淀,所以K2FeO4有消毒杀菌作用的原因是K2FeO4具有强氧化性,可杀菌消毒;可作净水剂的原因是还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物形成沉淀,
故答案为:K2FeO4具有强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物形成沉淀;
(2)由工艺流程可知,反应①足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O;故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应生成KClO,
故答案为:与“反应液I”中过量的Cl2继续反应生成KClO;
(4)根据溶液Ⅱ中分离K2FeO4后,还有副产品KNO3、KCl,则Fe(NO3)3溶液与碱性KClO溶液反应生成高铁酸钾和KNO3、KCl,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(5)因只要检验最后一次的洗涤中无Cl-,即可证明K2FeO4晶体已经洗涤干净,
故答案为:用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净.
点评 本题考查物质的分离和提纯,侧重考查学生分析能力和思维的缜密性,涉及氧化还原反应离子方程式的书写,会从整体上分析物质分离流程,知道每一步发生的反应及基本操作,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 取代,消去,加成 | B. | 加成,消去,取代 | C. | 消去,加成,取代 | D. | 取代,加成,消去 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粉末Zn与2mol•L-1硫酸溶液反应 | B. | 粉末状Mg与2mol•L-1硫酸溶液反应 | ||
| C. | 粉末状Na与2mol•L-1硫酸溶液反应 | D. | 粉末状Al与2mol•L-1硫酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某研究小组取一定质量的镁铝合金材料投入200mL稀硫酸中,待固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示.请回答下列问题
某研究小组取一定质量的镁铝合金材料投入200mL稀硫酸中,待固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示.请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛、乙醛、丙醛都没有同分异构体 | |
| B. | 已知甲醛是平面型分子,则苯甲醛的所有原子有可能在同一平面上 | |
| C. | 甲醛、乙醛、苯甲醛都能发生加成、氧化和酯化反应 | |
| D. | 可用新制的Cu(OH)2来区分甲醛和苯甲醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A.B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去).
A.B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用量筒量取16.28mL的浓硫酸 | |
| B. | 用托盘天平准确称取2.00g的NaOH固体 | |
| C. | 常温常压下1molO2的质量为32g | |
| D. | 用250mL的容量瓶配制30%的NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com