
| A. | 可用量筒量取16.28mL的浓硫酸 | |
| B. | 用托盘天平准确称取2.00g的NaOH固体 | |
| C. | 常温常压下1molO2的质量为32g | |
| D. | 用250mL的容量瓶配制30%的NaCl溶液 |
分析 A.量筒的最小读数为0.1mL;
B.托盘天平的最小读数为0.1g;
C.根据m=nM计算1mol氧气的质量;
D.容量瓶只能配制一定物质的量浓度的溶液,不能配制一定质量分数的溶液.
解答 解:A.量筒只能读到0.1mL,无法用量筒量取16.28mL的浓硫酸,可以用滴定管,故A错误;
B.托盘天平只能读到0.1g,无法用托盘天平准确称取2.00g的NaOH固体,故B错误;
C.1mol氧气的质量为:32g/mol×1mol=32g,故C正确;
D.用250mL的容量瓶只能配制250mL 一定物质的量浓度的溶液,不能配制30%的NaCl溶液,配制该溶液可以在烧杯中进行,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及量筒、托盘天平的使用方法、物质的量的计算、溶液配制等知识,明确常见仪器的构造为解答关键,注意掌握配制一定浓度溶液的方法,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:解答题
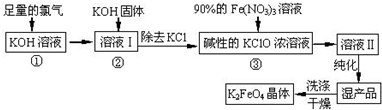
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2→H2SO4 | B. | SiO2→H2SiO3 | C. | Al2O3→Al(OH)3 | D. | Fe2O3→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
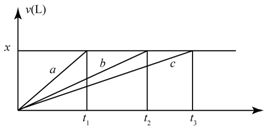 将等物质的量的金属Na、Mg、Al分别于100mL2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况),不正确的是( )
将等物质的量的金属Na、Mg、Al分别于100mL2mol•L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况),不正确的是( )| A. | x=2.24 | B. | 钠的物质的量为0.2 mol | ||
| C. | 反应时,Na、Mg、Al均过量 | D. | 曲线b为Mg与盐酸反应的图象 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL | B. | 33.3mL | C. | 100mL | D. | 66.7mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
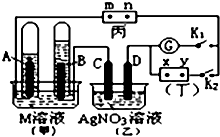 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com