
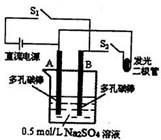
 如图是某研究小组进行化学能与电能相互转化的实验装置图( )
如图是某研究小组进行化学能与电能相互转化的实验装置图( )

 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
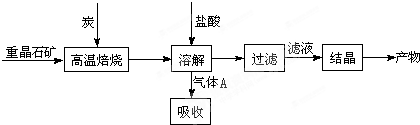
| 高温 |
| 高温 |
| c(Br-) |
| c(Cr-) |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓H2SO4△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
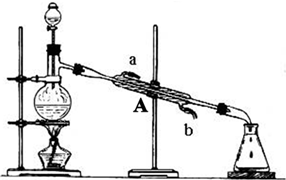
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
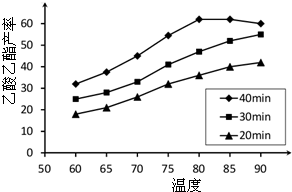
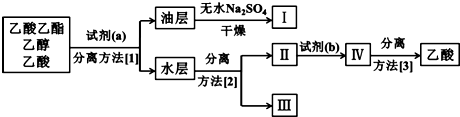
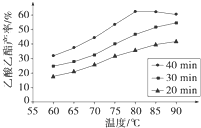 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)| 浓H2SO4 |
| △ |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com