
【题目】肼(N2H4)具有强还原性,可用作火箭燃料、抗氧剂等。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | a | b | c |
工业上合成氨的反应 N2(g)+3H2(g) 2NH3(g) ΔH=_____kJ·mol-1.
(2)肼—空气燃料电池是一种环保型燃料电池,结构如图 1 所示
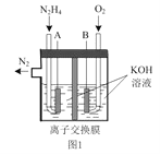
①肼—空气燃料电池的负极反应式为_____
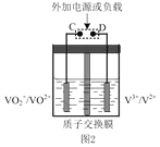
②全钒液流可充电电池结构如图 2 所示,将肼—空气燃料电池的 A 极与全钒液流可充电电池的 C 极相连,B 极与 D 极相连,写出阴极的电极反应____
(3)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,与使用 Na2SO3 处理水中溶解的 O2 相比,肼的优点是_____
【答案】b+3a-6c N2H4+4OH--4e- = N2↑+4H2O VO2++2H++e-=VO2++H2O 用肼处理,不会产生硫酸钠电解质,避免对锅炉造成腐蚀
【解析】
(1)利用反应物的总键能与生成物的总键能之差,可求出工业上合成氨反应N2(g)+3H2(g) 2NH3(g)的ΔH。
(2)①从图中可以看出,肼—空气燃料电池中,A为负极,B为正极,负极N2H4失电子的产物与OH-反应生成H2O和N2,由此可写出电极反应式。
② 肼—空气燃料电池的 A 极(负极)与全钒液流可充电电池的 C 极相连,则C极为阴极,B 极(正极)与 D 极(阳极)相连,则阴极(C极) VO2+得电子的产物与H+反应,生成H2O和VO2+,由此可写出电极反应式。
(3)肼处理水中的氧,生成N2和水,而Na2SO3 处理水中溶解的 O2,生成Na2SO4电解质,易使锅炉发生吸氧腐蚀。
(1) ΔH=反应物的总键能-生成物的总键能= [(b+3a)-6c] kJ·mol-1 =( b+3a-6c)kJ·mol-1。答案为:b+3a-6c;
(2)①由以上分析可知,肼—空气燃料电池中,A为负极,N2H4失电子的产物与OH-反应生成H2O和N2,电极反应式为N2H4+4OH--4e- = N2↑+4H2O。答案为:N2H4+4OH--4e- = N2↑+4H2O;
②肼—空气燃料电池中,阴极(C极) VO2+得电子的产物与H+反应,生成H2O和VO2+,电极反应式为VO2++2H++e- =VO2++H2O。答案为:VO2++2H++e- =VO2++H2O;
(3)肼处理水中的氧,生成N2和水,而Na2SO3处理水中溶解的O2,生成Na2SO4电解质,易使锅炉发生吸氧腐蚀,从而得出肼的优点是用肼处理,不会产生硫酸钠电解质,避免对锅炉造成腐蚀。答案为:用肼处理,不会产生硫酸钠电解质,避免对锅炉造成腐蚀。


科目:高中化学 来源: 题型:
【题目】化合物 的分子式均为C5H8O2,下列说法正确的是( )
的分子式均为C5H8O2,下列说法正确的是( )
A.x分子中碳原子均位于同一平面
B.x、y均能与NaOH溶液发生反应
C.y、z均能与![]() 反应生成
反应生成![]()
D.与它们互为同分异构体的链状羧酸有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马航失联事件震惊中外,事件发生后,联合搜救部门启用了“金枪鱼”水下搜救器展开水下搜救,其中![]() 电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为
电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为![]() ,则下列说法错误的是
,则下列说法错误的是![]()
![]()
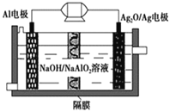
A.Al电极做负极,电极反应式为:![]()
B.工作时电解液中的OH-移向![]() 电极
电极
C.工作时正极发生还原反应,负极不断减重
D.当电极上生成![]() 时,电路中转移的电子为0.01mol
时,电路中转移的电子为0.01mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开 1mol Cl2(g)中Cl-Cl键需要吸收243kJ能量,根据能量变化示意图,下列说法或热化学方程式正确的是( )
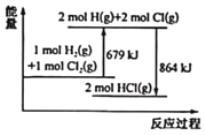
A.H2(g)+Cl2(g) = 2HCl(g) ΔH= + 185 kJ·mol-1
B.生成1mol H2(g)中的H-H键放出 121.5 kJ 能量
C.断开1mol HCl(g)中的H-C1键要吸收 864 kJ 能量
D.HCl(g) =![]() H2(g)+
H2(g)+![]() Cl2(g) ΔH= + 92.5kJ·mol-1
Cl2(g) ΔH= + 92.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有一反应:3Fe2++2S2O32—+O2+xOH-===Fe3O4+S4O62—+2H2O,下列说法中不正确的是( )
A.x=4
B.1molFe2+被氧化时,被Fe2+还原的O2的物质的量为![]() mol
mol
C.Fe2+和S2O32—都是还原剂
D.每生成1molFe3O4,反应转移的总电子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO、NO2等多种污染物。
(1)在汽车的排气管上装一个催化转换装置,能使CO和NO反应生成无污染的气体,写出该反应的化学方程式_____
(2)研究表明:增大催化剂(相同质量下比较)比表面积可提高化学反应速率,为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | CO 初始浓度/mol·L-1 | NO 初始浓度/mol·L-1 | 催化剂的比表面积/m·g-1 |
Ⅰ | 300 | 4.5×10-3 | 1.5×10-3 | 100 |
Ⅱ | ______ | 4.5×10-3 | 1.5×10-3 | 200 |
Ⅲ | 500 | 4.5×10-3 | _________ | 200 |
请在上表格中填入剩余的实验条件数据,三组实验中的反应速率由快到慢的顺序为 ______(填实验编号)
(3)大众"检测门"事件让"尿素可用于汽车尾气脱氮”又科普了一把,其反应原理为:NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O
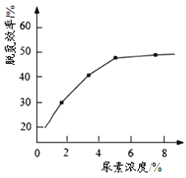
① 图为尿素含量对脱氮效率的影响,一般选择尿素浓度约5%左右,其原因是_______
②当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO):V(NO2)=3:1时,可通入一定量的空气,同温同压下,V(空气):V(NO2)=_____(空气中氧气的体积含量大约为 20%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是工业的血液,通过它可以得到很多重要的化工产品。

已知: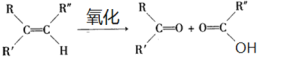
(1)B和A为同系物,B的结构简式为_________________;
(2)反应①的化学方程式为__________________,其反应类型为___________;
(3)写出检验C3H5Cl中含有Cl原子的方法:______________;
(4)C的结构简式为______________;
(5)反应④的化学方程式为_______________;
(6)设计一条由乙烯为原料制备D的合成路线(其他无机原料任选)____________。(合成路线格式如下:CH3CH2OH ![]() H2C=CH2
H2C=CH2 ![]() BrCH2CH2Br)
BrCH2CH2Br)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.因SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B.向 50 mL 18.4 mol/L H2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量小于0.46 mol
C.SO2、NO2 和 CO2 都是引起酸雨的主要原因,导致雨水的 pH 小于5.6
D.等物质的量的SO2和Cl2混合后通入装有湿润有色布条的集气瓶中,漂白效果更好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com