
根据反应:S2O32-+2H+==SO2+S↓+H2O,下表各组实验最快出现浑浊的是
Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | |||
c(mol·L-1) | V(mL) | c(mol·L-1) | V(mL) | V(mL) | ||
A | 0.1 | 5 | 0.1 | 5 | 5 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源:2014-2015学年山东省青岛市高三下学期一模考试理综化学试卷(解析版) 题型:选择题
下列有关原子结构、元素性质的说法正确的是
A.Si、P、S、Cl元素的单质与氢气化合越来越容易
B.元素原子最外层电子数越多,元素金属性越强
C.元素周期表共有18列,第3列是第ⅠB族,第17列是第ⅦA族
D.F﹣、O2﹣、Mg2+、Na+离子半径逐渐减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市三校高三下学期3月质量检测化学试卷(解析版) 题型:实验题
B.草酸二乙酯可用于苯巴比妥等药物的中间体,实验室以草酸(HOOC—COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下:

步骤1:在上图所示装置中,加入无水草酸45g,无水乙醇81g,苯200mL,浓硫酸10mL,搅拌下加热6870℃回流共沸脱水。
步骤2:待水基本蒸完后,分离出乙醇和苯。
步骤3:所得混合液冷却后依次用水、饱和碳酸氢钠溶液洗涤,再用无水硫酸钠干燥。
步骤4:常压蒸馏,收集182-184℃的馏分,得草酸二乙酯57g。
(1)步骤1中发生反应的化学方程式是 ,反应过程中冷凝水应从 (填“a”或“b”)端进入。
(2)步骤2操作为 。
(3)步骤3用饱和碳酸氢钠溶液洗涤的目的是 。
(4)步骤4除抽气减压装置外所用玻璃仪器有蒸馏烧瓶、冷凝管、接液管、锥形瓶和 。
(5)本实验中,草酸二乙酯的产率为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市三校高三下学期3月质量检测化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.一定条件下,0.2mol SO2与足量O2充分反应,生成SO3分子数为0.2NA
B.0.1mol—NH2(氨基)中含有的电子数为0.7NA
C.3.4g H2O2中含有的共用电子对数为0.1NA
D.常温常压下,16g O2和O3混合气体含有的氧原子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省肇庆市高三一模化学试卷(解析版) 题型:填空题
(16分)
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g)=CO(g) + 3H2(g) △H=+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H =-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H= 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应器,在一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图。假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 mol·L-1·min-1。

(3)在某温度和压强下,将一定量 CO与H2充入密闭容器发生反应II生成甲醇,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
a.c ( H2 )减少;
b.平衡常数K增大;
c.CH3OH 的物质的量增加;
d.正反应速率加快,逆反应速率减慢;
e.重新平衡c ( H2 )/ c (CH3OH )减小。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,

则:
Co2+在阳极的电极反应式为: ;
除去甲醇的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三一模考试理综化学试卷(解析版) 题型:填空题
(16分)氮及其化合物在化学实验中有广泛应用:
(1)请写出实验室用Cu和稀硝酸反应制备NO的离子方程式: ;
(2)请设计实验,检验某可溶性固体物质中含有NH4+的操作、现象、结论: ;
(3)实验室可用(NH4)2Cr2O7受热分解产生N2、Cr2O3和H2O来制备N2,请写出该分解反应的化学方程式: ;
(4)有人发现重铬酸铵分解产物不仅含N2、Cr2O3和H2O,还含有NH3和O2,并指出伴随有显著的副反应发生:2(NH4)2Cr2O7 2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
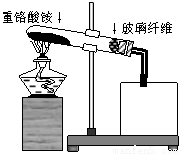
限选试剂:Na2S溶液、Na2SO3溶液、FeSO4溶液;
限选仪器:试管、玻璃导管、漏斗、烧杯、胶头滴管
①图中试管口玻璃纤维的作用是 ;
②根据实验目的,选择一种试剂和最佳的仪器补全该实验装置(在方框中画图并标注所选试剂);
③写出该法验证NH3和O2存在的实验原理的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三一模考试理综化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | 测得纳米材料Fe3O4的微粒直径为90 nm | 纳米材料Fe3O4属于胶体 |
B | C(金刚石,s)===C(石墨,s) ΔH=-1.5 kJ·mol-1 | 通常石墨比金刚石稳定 |
C | Si有良好的半导体性能 | Si可用于制备光导纤维 |
D | 海水中含有大量的Cl-、Br-等离子 | 向海水中通入F2可大量获得Cl2、Br2 |
查看答案和解析>>
科目:高中化学 来源:2014-2015河北枣强中学高一上学期期末考试化学试卷(解析版) 题型:选择题
已知a、b、c是中学常见的含有同种元素的三种物质,具有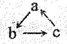 的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是
的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是
选项 对应物质 | A | B | C | D |
a | Cu(OH)2 | Na2O | Fe | Mg |
b | CuCl2 | NaCl | FeCl3 | MgO |
c | Cu | Na | FeCl2 | MgCl2 |
查看答案和解析>>
科目:高中化学 来源:2014-2015河北枣强中学高二上学期期末考试化学试卷(解析版) 题型:选择题
用已知物质的量浓度的酸测定未知物质的量浓度的碱时,会导致待测碱液的物质的量浓度偏低的操作是
①酸式滴定管在滴定前未将液面调至“0”刻度,而调在“2.40”
②碱式滴定管用蒸馏水洗后,未用待测 液润洗
③滴定前酸式滴定管尖嘴部分未充满溶液,滴定后充满溶液
④滴定中不慎将锥形瓶内液体摇出瓶外
⑤滴定达终点时,视线高于滴定管内液面凹面的最低点
A.①②④ B.②③④ C.②③⑤ D.②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com