
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.一定条件下,0.2mol SO2与足量O2充分反应,生成SO3分子数为0.2NA
B.0.1mol—NH2(氨基)中含有的电子数为0.7NA
C.3.4g H2O2中含有的共用电子对数为0.1NA
D.常温常压下,16g O2和O3混合气体含有的氧原子数为NA
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源:2015年期中备考总动员高三化学模拟卷【福建】3(解析版) 题型:选择题
【改编】列与有机物的结构.性质有关的叙述正确的是
A.乙烯通入酸性KMn04溶液中,紫色褪去,是因为发生了加成反应
B.糖类、油脂、蛋白质都属于天然高分子化合物
C.葡萄糖.果糖的分子式均为C6H12O6,二者互为同分异构体
D.可用热的NaOH溶液除去乙酸乙酯中的乙酸杂质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高三第三次四校联考理综化学试卷(解析版) 题型:填空题
选考[化学---选修3:物质结构与性质] (15分)
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是IIIA族元素,写出铟基态原子的电子排布式: 。
(2)硒为第四周期VIA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为 。(用元素符号表示)
(3)SeO3分子的立体构型为 。
(4)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 。

(5)硼元素具有缺电子性,其化合物往往具有加合性,如硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-,其中B原子的杂化类型为 。
(6)金属铜投入氨水中或投入H2O2溶液中均无明显现象,但投入氨水—过氧化氢混合液中,则铜片溶解,溶液呈深蓝色,写出该反应的离子方程式: 。
(7)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞参数为a pm,则该合金密度为 g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市三校高三下学期3月质量检测化学试卷(解析版) 题型:推断题
(15分)葛根大豆苷元(F)用于治疗高血压引起的头疼、突发性耳聋等症,其合成路线如下:

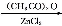
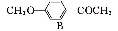








(1)化合物C中的含氧官能团有 、 (填官能团名称)。
(2)已知:C D为取代反应,其另一产物为H2O,写出X的结构简式: 。
D为取代反应,其另一产物为H2O,写出X的结构简式: 。
(3)反应E F的反应类型是 。
F的反应类型是 。
(4)写出同时满足下列条件的B的两种同分异构体的结构简式: 。
Ⅰ.属于芳香族化合物,分子中有4种不同化学环境的氢
Ⅱ.能与FeCl3溶液发生显色反应
Ⅲ.不能发生水解反应,能发生银镜反应
(5)根据已有知识并结合相关信息,写出以 和(CH3CO)2O为原料制备药物中间体
和(CH3CO)2O为原料制备药物中间体 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
H2C CH2
CH2 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市三校高三下学期3月质量检测化学试卷(解析版) 题型:选择题
下图装置可处理乙醛废水,乙醛在阴、阳极发生反应,分别转化为乙醇和乙酸。下列说法正确的是
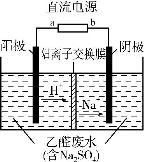
A.b电极为正极
B.电解过程中,阴极区Na2SO4的物质的量增大
C.阳极电极反应式为CH3CHO-2e-+H2O CH3COOH+2H+
CH3COOH+2H+
D.电解过程中,两极均有少量气体产生,则阳极产生的是H2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省肇庆市高三一模化学试卷(解析版) 题型:填空题
(17分)铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,请图甲中的横线上完成标注。

②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ==4OH-;
若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后,直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省肇庆市高三一模化学试卷(解析版) 题型:选择题
根据反应:S2O32-+2H+==SO2+S↓+H2O,下表各组实验最快出现浑浊的是
Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | |||
c(mol·L-1) | V(mL) | c(mol·L-1) | V(mL) | V(mL) | ||
A | 0.1 | 5 | 0.1 | 5 | 5 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
查看答案和解析>>
科目:高中化学 来源:2014-2015河北枣强中学高一上学期期末考试化学试卷(解析版) 题型:填空题
(10分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是: 。
不采用铜跟浓硫酸反应来制取硫酸铜的原是 。
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 。
(4)将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015河北枣强中学高二上学期期末考试化学试卷(解析版) 题型:选择题
某烃的结构简式为 ,它可能具有的性质是
,它可能具有的性质是
A.易溶于水,也易溶于有机溶剂
B.既能使溴水褪色,又能使酸性KMnO4溶液褪色
C.能发生聚合反应,其产物可表示为 -
-
D.能使溴水褪色,但不能使酸性KMnO4溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com