
【题目】下列变化中,气体被还原的是
A.水蒸气使 CuSO4固体变蓝B.氯气使浅绿色 FeC12 溶液变黄
C.H2使灼热CuO 固体变红D.氨气使A1Cl3溶液产生白色沉淀
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一:制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
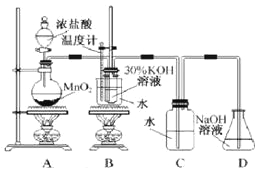
(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有__。
(2)若对调B和C装置的位置,__(填“能”或“不能”)提高B中氯酸钾的产率。
实验二:氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
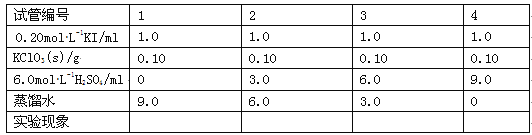
①系列a实验的实验目的是__。
②设计1号试管实验的作用是__。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__。
实验三:测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用如图装置,加热15.0ml饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是__。(不考虑实验装置及操作失误导致不可行的原因)
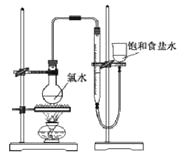
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):__。
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
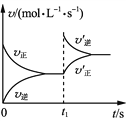
A. t1时刻充入H2,v′正、v′逆变化如右图
B. 第一次达平衡时,H2的体积分数小于20%
C. 温度为T时,起始向原容器中充入0.1 mol铁粉、0.04 mol H2O(g)、0.1 mol Fe3O4(s)、0.005 mol H2(g),反应向正反应方向进行
D. 温度为T时,向恒压容器中加入足量Fe3O4(s)和0.08 mol H2 (g),达平衡时H2(g)转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧硫酸氢钾复合盐(K2SO4KHSO42KHSO5)易分解,可用作漂白剂、NOx和SO2等的脱除剂。某研究小组制备过氧硫酸氢钾复合盐的流程如图所示。

已知:浓硫酸与H2O2反应,部分转化为过硫酸(化学式为H2SO5,是一种一元强酸)
(1)H2SO5中硫元素的化合价为+6价,其中过氧键的数目为________;工业上用过氧硫酸氢钾复合盐溶液脱除NO时,反应的离子方程式为___________________________。
(2)若反应物的量一定,在上述流程的“转化”步骤中需用冰水浴冷却,且缓慢加入浓硫酸,其目的是___________________________。
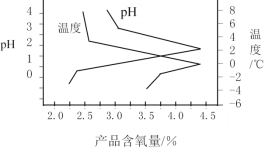
(3)“结晶”操作中,加入K2CO3即可获得过氧硫酸氢钾复合盐晶体,该过程的化学方程式为______________________________。过氧硫酸氢钾复合盐产率(以产品含氧量表示)随溶液pH和温度的变化关系如图所示,则该过程适宜的条件是_________________。
(4)产品中KHSO5含量的测定:取1.000g产品于锥形瓶中,用适量蒸馏水溶解,加入5mL5%的硫酸和5mL25%的KI溶液,再加入1mL淀粉溶液作指示剂,用0.2000mol·L-1硫代硫酸钠标准液滴定至终点,消耗标准液的体积为25.00mL。
已知:2KHSO5+4KI+H2SO4 = 2I2+3K2SO4+2H2O I2+2Na2S2O3 =Na2S4O6+2NaI
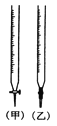
①用_____滴定管盛装标准浓度的硫代硫酸钠溶液(填“甲”或“乙”)。
②产品中KHSO5的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PBAT(聚己二酸对苯二甲酸丁酯)可被微生物几乎完全降解,成为包装、医疗和农用薄膜等领域的新兴材料,它可由聚合物PBA和PBT共聚制得,一种合成路线如下:
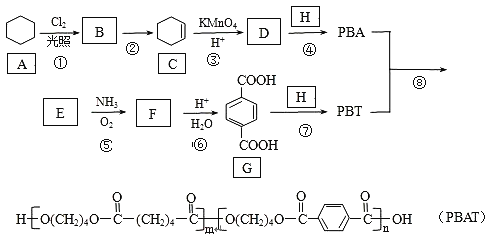
已知:R—CH3![]() R—CN
R—CN![]() R—COOH
R—COOH
R-CH=CH2![]() R-COOH+CO2
R-COOH+CO2
回答下列问题:
(1)G的官能团的名称为________。
(2)①的反应类型为___________;反应②所需的试剂和条件是___________。
(3)D的结构简式为___________;H的化学名称为___________。
(4)⑤的化学方程式为______________。
(5)M与G互为同系物,M的相对分子质量比G大14;N是M的同分异构体,写出同时满足以下条件的N的结构简式:___________(写两种,不考虑立体异构)。
Ⅰ、既能与FeCl3发生显色反应,又能发水解反应和银镜反应;
Ⅱ、与NaOH溶液反应时,1mol N能消耗4molNaOH;
Ⅲ、核磁共振氢谱有五组峰,峰面积比为1:2:2:2:1。
(6)设计由丙烯为起始原料制备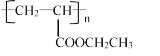 的单体的合成路线(其它试剂可任选)____________。
的单体的合成路线(其它试剂可任选)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如图:
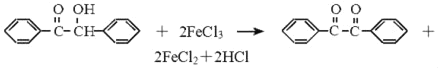
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加热煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶 液重结晶提纯。重结晶过程:
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答下列问题:
(1)写出装置图中玻璃仪器的名称:b_____。
(2)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:_____。
A.缓慢冷却溶液 B.溶液浓度较高 C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液中发生过饱和现象,可采用_____等方法促进晶体析出。
(3)抽滤所用的滤纸应略_____(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。 烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是_____。
A.无水乙醇 B.饱和NaCl溶液 C.70%乙醇水溶液 D.滤液
(4)抽滤过程中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为_____。
(5)上述重结晶过程中的哪一步操作除去了不溶性杂质:_____。
(6)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15min、30min、45min和60min时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是_____。
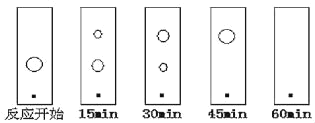
A.15min B.30min C.45min D.60min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL0.40molL-1H2O2在MnO2作用下发生反应 :2H2O2 ( aq)=2H2O(l )+O2( g) △H <0, 不同时刻测定生成O2的物质的量如下表所示 :
t/min | 0 | 3 | 6 | 10 | ……. |
n(O2)/mol | 0.0 | 0.0008 | 0.001 | 0.0012 | ……. |
下列叙述不正确的是(溶液体积变化忽略不计)
A.升高温度,可加快H2O2 的分解速率
B.若增大溶液起始浓度,则收集到 0.0 008 mol O2 的时间会小于3 min
C.反应至 6min 时,溶液 中 c(H2O2)=0.2mol L-1
D.反应至 12min 时,H2O2分解率为 65%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用11.92gNaClO配成溶液,向其中加入0.01molNa2SX恰好完全反应,生成Na2SO4和NaCl。则Na2SX 中的 x=__________(写出简要计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯巴比妥是镇静、安眠类药物,其合成路线如下:
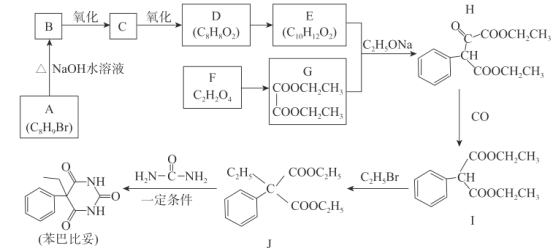
请回答下列问题:
(1)G的化学名称为_________,C的分子式为__________。
(2)F+X→G+ H2O,X的结构简式为____________。
(3)H中含有的官能团名称为__________,I→J的反应类型为______________。
(4)同时满足下列条件的E的同分异构体共有______种。
①含有苯环且苯环上有两个取代基
②能发生水解反应且能发生银镜反应
(5)化合物J→苯巴比妥的化学方程式为________________________________。
(6)以1,3-丁二烯、乙醇和尿素(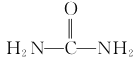 )为原料合成
)为原料合成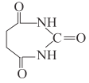 所需无机试剂任选,请写出流程:_____________________________
所需无机试剂任选,请写出流程:_____________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com