
【题目】下表中物质的分类组合完全正确的是
编 号 | A | B | C | D |
强电解质 | KNO3 | H2SO4 | Ba(OH)2 | BaSO4 |
弱电解质 | CH3COOH | CaCO3 | H2S | NH3·H2O |
非电解质 | SO2 | CO2 | Cl2 | C2H5OH溶液 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是

A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化物按其溶解性可以分三类:①易溶于水的有K2S,Na2S,(NH4)2S等;②易溶于非氧化性强酸,不溶于水的有FeS,ZnS等;③大部分的硫化物既不溶于水也不溶于非氧化性强酸,如HgS,Ag2S,CuS,Cu2S等。其中,Ag2S,CuS,Cu2S能溶于硝酸发生氧化还原反应,而HgS只能溶于王水。
(1)推测硫化氢通入硫酸铜溶液中能否发生反应?若能,写出反应的离子方程式;若不能,写出原因 。
(2)在氢硫酸溶液中改变下列条件,能使溶液中c(OH-)、c(S2-)都增大的是 。
A.加入少量的漂白粉 B.通入氨气
C.加入少量过氧化钠粉末 D.加入少量硝酸银溶液
(3)已知在常温下,FeS的Ksp=6.25×10-18,H2S饱和溶液中c(H+)与c(S2-)之间存在如下关系:c2(H+)·c(S2-)=1.0×10-22。在该温度下,将适量FeS投入硫化氢饱和溶液中,欲使溶液中c(Fe2+)达到1 mol·L-1,应调节溶液的pH为____________(已知lg2=0.3)。
(4)将Hg加入到一定浓度的H2S溶液中,有氢气产生,原因为 。
(已知Hg在溶液中,存在平衡:Hg-2e—![]() Hg2+)
Hg2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 物质不是电解质就是非电解质
B. 酸性氧化物不一定都是非金属氧化物,而非金属氧化物一定是酸性氧化物
C. 能导电的物质不一定是电解质,电解质也不—定能导电
D. 液氨溶于水能导电,所用是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),CH3OH(g) + H2O(g)![]() CO2(g) + 3H2(g)
CO2(g) + 3H2(g) ![]() H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下反应达平衡状态的依据是(填序号) 。
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热Q kJ。则表示甲醇燃烧热的热化学方程式为_____________________。
(3)对于H2O2分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
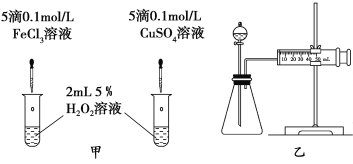
①定性分析:如图甲可通过观察__________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___________。
②定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是 ,实验中需要测量的数据是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述正确的是
A. 氟利昂-12的结构式为 ,该分子是平面型分子
,该分子是平面型分子
B. 苯与液溴混合后撤入铁粉发生了加成反应
C. 分子式为C4H9Cl的同分异构体共有4种
D. 1mol苹果酸(HOOCCHOHCH2COOH)可与3molNaHCO3发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016-2017学年辽宁省重点高中协作校高二上学期期中化学卷】电离度是描述弱电解质电离程度的物理量,电离度=(己电离的物质的量/原来的总物质的量)X 100%。现取20 mL pH=4的CH3COOH溶液,加入0.2 mol L-1的氨水,测得溶液导电性变化如下图,则加入氨水前CH3COOH的电离度为
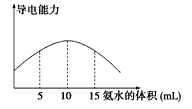
A.0.5% B.0.1% C.1.5% D.1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【陕西省榆林市2017届高考模拟第一次测试理综】常温下,各取1mL PH=2的两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
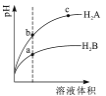
A. H2A的酸性比H2B弱
B. c点溶液的导电性比a,b点溶液的导电性都强
C. 若0.1mol/LNaHA溶液的PH=4,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A) >c(H+)>c(OH-)
D. Na2B的水溶液中,离子浓度大小为试卷c(Na+)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究。
回答下列问题:
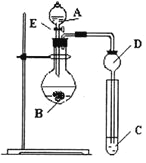
(1)图中D装置名称是 。
(2)从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液②稀盐酸③碳酸钙④Na2SiO3溶液⑤SiO2
试剂A为_________;试剂C为_________(填序号)。
(3)乙同学设计的实验所用到试剂A为________;试剂C为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com