
【题目】由C、H、O三种元素组成的有机物A,相对分子质量为104。0.1molA充分燃烧后,将所得产物依次通入足量浓硫酸和氢氧化钠溶液,浓硫酸增重7.2g,氢氧化钠溶液增重17.6g。回答下列问题:
(1)有机物A的分子式是________。
(2)A能与碳酸氢钠反应,A中含有的官能团的名称是________。
(3)A与浓硫酸共热可生成一种由五个原子构成的环状化合物B。写出化学方程式:____________________________________________。
(4)A与浓硫酸共热还可以生成一种能使Br2的四氯化碳溶液褪色的化合物C。写出A生成C的化学方程式:________________________________;
反应类型是________。利用C可以合成高分子化合物D,D的结构简式是________。
(5)A的一种同分异构体E,经测定分子结构中含有一个—CH3,两个![]() ;能与银氨溶液反应产生银镜现象。写出E与Ag(NH3)2OH溶液反应的化学方程式:
;能与银氨溶液反应产生银镜现象。写出E与Ag(NH3)2OH溶液反应的化学方程式:
__________________。
【答案】 C4H8O3 羧基 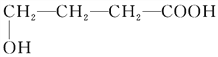
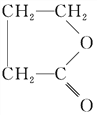
![]()
 +H2O
+H2O 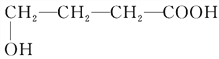
![]() CH2=CH—CH2—COOH+H2O 消去反应
CH2=CH—CH2—COOH+H2O 消去反应 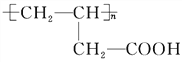
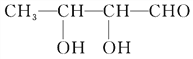 +2[Ag(NH3)2]OH
+2[Ag(NH3)2]OH![]()
 +3NH3+2Ag↓+H2O
+3NH3+2Ag↓+H2O
【解析】0.1molA充分燃烧后,将所得产物依次通入足量浓硫酸和氢氧化钠溶液,浓硫酸增重7.2g,即A充分燃烧后生成水为0.4mol,氢氧化钠溶液增重17.6g,即A充分燃烧后生成二氧化碳的物质的量为0.4mol,由于可知分子A中有4个碳原子和8个氢原子,由C、H、O三种元素组成的有机物A,A的相对分子质量为104,所以分子A中含有氧原子数为![]() =3,据此可以确定A的分子分C4H8O3。
=3,据此可以确定A的分子分C4H8O3。
(1)根据上面的分析可知,有机物A的分子式是C4H8O3,故答案为:C4H8O3;
(2)A为HOCH2CH2CH2COOH,A能与碳酸氢钠反应,说明A中含有羧基,故答案为:羧基;
(3)A与浓硫酸共热可生成一种由五个原子构成的环状化合物B的化学方程式为: ,故答案为:
,故答案为: ;
;
(4)A为HOCH2CH2CH2COOH,C为CH2=CHCH2COOH,A生成C的化学方程式:![]() ;反应类型是:消去反应,根据上面的分析可知,D的结构简式是:
;反应类型是:消去反应,根据上面的分析可知,D的结构简式是:![]() ,故答案为:
,故答案为:![]() ;消去反应;
;消去反应;![]() ;
;
(5)A的一种同分异构体E,经测定分子结构中含有一个-CH3,两个-CH-,能与银氨溶液反应产生银镜现象,则E中有醛基,所以E为CH3CH(OH)CH(OH)CHO,E与Ag(NH3)2OH溶液反应的化学方程式为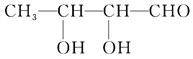 +2[Ag(NH3)2]OH
+2[Ag(NH3)2]OH![]()
 +3NH3+2Ag↓+H2O,故答案为:
+3NH3+2Ag↓+H2O,故答案为: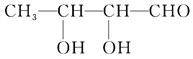 +2[Ag(NH3)2]OH
+2[Ag(NH3)2]OH![]()
 +3NH3+2Ag↓+H2O。
+3NH3+2Ag↓+H2O。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在日常生活中出现了“增铁酱油”、“高钙奶粉”、“富硒茶叶”、“含氟牙膏”、“加碘食盐”等商品。这里的铁、钙、硒、氟、碘应理解为 ( )
A. 单质 B. 分子 C. 氧化物 D. 元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;X与M同主族; Z、N分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)元素Y在周期表中的位置_______________。
(2)Z、M、N三种元素简单离子半径由大到小的顺序是(用元素符号表示)________________。
(3)X与Z能以原子个数比2:1和1:1形成两种化合物,其中既含极性键又含非极性键的化合物的电子式为____________。
(4) Z的简单氢化物比同族元素的简单氢化物沸点_____(“高”或“低”),原因是_______。
(5)元素Z和M在常温下可以直接化合,用电子式表示其形成过程__________。
(6)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
A![]() B(在水溶液中进行) , 其中,C是溶于水显酸性的气体;D是淡黄色固体。
B(在水溶液中进行) , 其中,C是溶于水显酸性的气体;D是淡黄色固体。
①写出C的结构式:________;
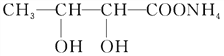
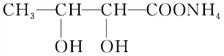
②如果A、B均由三种元素组成,且B为两性不溶物。则A和过量的C反应生成B的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)湿法制备高铁酸钠(Na2FeO4)的反应体系有六种微粒:Fe(OH)3、ClO-、OH-、FeO![]() 、
、
Cl-、H2O。
①写出并配平湿法制备高铁酸钠的离子方程式:__________________________。
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),最可能的原因是_________________________________________________________________。
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中的还原剂是________________,氧化产物是____________,每生成1 mol Na2FeO4转移________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是
A.元素周期表中有 8 个主族
B.IA 族中的元素全部是金属元素
C.第三周期有 8 种元素
D.短周期元素是指第一 、二周期所含有的全部元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设N A 代表阿伏加德罗常数的值,下列说法正确的是
A. 1 mol Na在空气中完全燃烧,转移的电子数为2 N A
B. 常温下,2.7 g铝与足量NaOH溶液反应,消耗0.1 N A个OH-
C. 0.1 mol Fe 与足量水蒸气反应,生成H2的分子数为0.1 N A
D. 11.2 L Cl2含有的原子数为N A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是
A.电解池是电能转化为化学能的装置
B.原电池跟电解池连接后,电子从原电池负极流向电解池阴极,经过电解质溶液到达电解池的阳极,然后再回流到原电池的正极,形成闭合回路
C.电解时,阳极发生氧化反应
D.电解时,阳离子移向阴极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com