
【题目】己知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻且A与D同族,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C 位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号或其相应化学式表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为___________________。
(2)B的氢化物的空间构型为__________。
(3)E核外电子排布式是_______________,E的某种化合物的结构如下图所示,

微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有_______。
a.离子键 b.极性键 c.配位键 d.氢键
(4)A与B的气态氢化物的沸点_______更高,A与D的气态氢化物的沸点_______更高。
(5)A的稳定氧化物中,中心原子的杂化类型为_________,空间构型为________。
【答案】 N>C>Si>Na 三角锥形 [Ar]3d104s1 a,b,c,d NH3 SiH4 sp 直线形
【解析】A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。C原子在同周期原子中半径最大(稀有气体除外),则C处于IA族,故A、B的周期数小于C的周期数,则A、B二者一定处于短周期,由于E与C位于不同周期,E的原子序数大于C,则C不可能处于第四周期,故C也是短周期元素,A原子核外有两个未成对电子,则外围电子排布为ns2np2或ns2np4,而B元素的第一电离能比同周期相邻两个元素都大,B为ⅡA族或ⅤA族元素,且A与B在周期表中位置相邻,B只能为VA族元素,A、B的周期数小于C,则A、B处于第二周期,C处于第三周期,故B为N元素,C为Na,A的原子序数小于B,只能为ⅣA族元素,故A为碳元素,A与D在周期表中位置相邻,D的原子序数大于Na,故D为Si;E为第四周期原子,原子核外最外层电子数与C相同,其余各层电子均充满,则原子核外电子数为2+8+18+1=29,故E为Cu。
(1)同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性:N>C>Si>Na;(2)氮元素的氢化物是氨气,空间构型是三角锥形;(3)E为Cu元素,原子核外电子排布式是[Ar]3d104s1。由E的某种化合物的结构图可知,铜离子与水分子之间形成配位键,水分子之间形成氢键,水分子中、硫酸根离子中存在共价键,硫酸根离子与配离子之间形成离子键,答案选abcd;(4)氨气分子间存在氢键,沸点高于甲烷;CH4和SiH4的结构相似,均是分子晶体,分子间作用力越大,沸点越高,则SiH4更高。(5)A的稳定氧化物是CO2,是直线形结构,中心原子的杂化类型为sp杂化。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是
A.2Na218O2+2H2O=4Na18OH+O2↑
B.2KMnO4+5H218O2+3H2SO4=K2SO4+2MnSO4+518O2↑+8H2O
C.NH4Cl+2H2O![]() NH3·2H2O+HCl
NH3·2H2O+HCl
D.K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止食品受潮及富脂食品氧化变质,在食品包装袋中应放入的化学物质是( )
A. 无水硫酸铜和蔗糖 B. 硅胶和硫酸亚铁
C. 食盐和硫酸亚铁 D. 生石灰和食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g) +B(g)![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s 内正反应的化学反应速率为___________________;
(2)反应前A的物质的量浓度是___________________________;
Ⅱ、某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) 反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为___________。
2SO3(g) 反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为___________。
III、已知在容积固定的密闭容器中充入NH3和O2发生如下反应:
4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
下列能说明该反应已经达到平衡状态的是___________;
A.容器中气体总质量不变 B.c(O2)不变 C.v (O2)=1.25 v(NH3)
D.体系压强不变 E.相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
Ⅳ、在一定条件下,可实现如图所示物质之间的变化:

(1)已知孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。
则图中的F是____________(填化学式)。
(2)写出明矾[KAl(SO4)2·12H2O] 与过量NaOH溶液反应的离子方程式:
_____________________________________________。
(3)图中所得C和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式:
________________________________________________。
Ⅴ、海带提碘的流程如下:

(1)第②步为了加快溶解速率并使充分进入溶液中,可以采取的措施是:
______________________、______________________(写出两条)。
(2)写出第④步发生反应的离子方式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯可以通过丁二烯与乙烯发生环化加成反应得到:
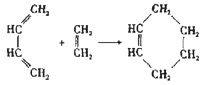 (也可表示为:
(也可表示为: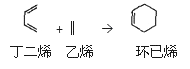 )
)
实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化:
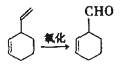
现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷:
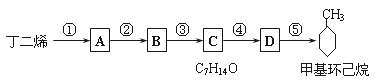
请按要求填空:
(1)A的结构简式是________________;B的结构简式是_______________。
(2)写出下列反应的化学方程式和反应类型:反应④______________,反应类型_____反应;⑤_____________,反应类型_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是

A.30min时降低温度,40min时升高温度
B.反应方程式中的x=1,正反应为吸热反应
C.8min前A的平均反应速率为0.08mol/(Lmin)
D.30min~40min间该反应使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜的配合物A结构如图图1。请回答下列问题:
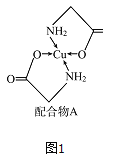
(1)写出基态Cu的外围电子排布式________
(2)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和x键数目之比是___;N2O与CO2互为等电子体,则N2O的电子式为_______。
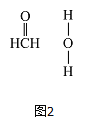
(3)在Cu催化下,甲醇可被氧化为甲醛,甲醇分子中HCO的键角____(选填“大于”、“等于”或“小于”) l20°;甲醛能与水形成氢健,请在如图2中表示出来____。
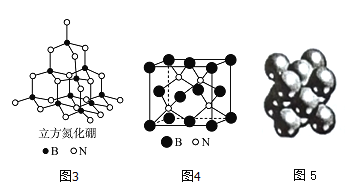
(4)立方氮化硼如图3、图4与金刚石结构相似,是超硬材料。立方氮化硼晶体内B一N键数与硼原子数之比为__________;
(5)Cu晶体的堆积方式如图5所示,设Cu原子半径为a,晶体中Cu原子的配位数为_____,晶体的空间利用率为_________。(已知:![]() ,列式并计算出结果)
,列式并计算出结果)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com