
【题目】下列措施不符合“绿色化学”思想的是( )
A.循环使用物料
B.用水代替有机溶剂
C.直接排放电镀废水
D.发展原子利用率达到100%的化学反应
科目:高中化学 来源: 题型:
【题目】下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A.向NaHCO3固体中加入新制的氯水,有无色气泡产生(H+)
B.新制氯水使红色布条褪色(HCl)
C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-)
D.向碘化钾淀粉溶液中滴加新制氯水,溶液呈蓝色(Cl2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)原子结构示意图为:
(1)锗位于元素周期表中的第_________周期,第________族,
(2)最高价氧化物化学式为________,对应水化物化学式为___________。
(3)根据示意图: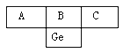
推得A、B、C依次为______、____、_____元素。A、B、C中,________是典型的非金属元素(填元素符号,下同),__________的最高价氧化物具有两性;可用作半导体的是_______,可作导体是________,常用来制农药的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同学们已经学习了几种典型的有机化学反应类型——取代反应、加成反应、酯化反应。写出下列反应的化学反应方程式,并判断其反应类型。
①乙醇与金属钠反应:_____________________________,属于___________反应;
②由苯制取硝基苯:_______________________________,属于____________反应;
③由苯制取环己烷:_______________________________,属于____________反应;
④乙烯使溴水褪色:_______________________________,属于____________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行有关卤素及其化合物的制备和性质探究实验,请同学们参与他们的实验并回答下列问题。
【实验一】氯气的制备与性质
(1)用下图所示的实验装置来制备纯净、干燥的氯气,并完成它与金属铁的反应。每个虚线框表示一个单元装置,其中有错误的是_____(填字母序号)。
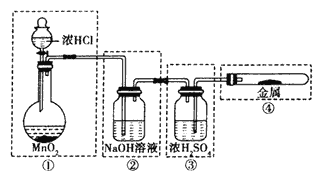
A.只有②和④ B.只有② C.只有①和③ D.②③④
【实验二】卤素化合物的性质实验探究
已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在100℃左右时升华,易溶于水并且有强烈的吸水性。在500℃条件下氯化亚铁与氧气可能发生多种反应,如:12FeCl2+3O2![]() 2Fe2O3+8FeCl3、4FeCl2+3O2
2Fe2O3+8FeCl3、4FeCl2+3O2![]() 2Fe2O3+4Cl2等。该兴趣小组选用以下部分装置(夹持装置省略,装置不可重复选用)进行氯化亚铁与氧气反应产物的探究。
2Fe2O3+4Cl2等。该兴趣小组选用以下部分装置(夹持装置省略,装置不可重复选用)进行氯化亚铁与氧气反应产物的探究。
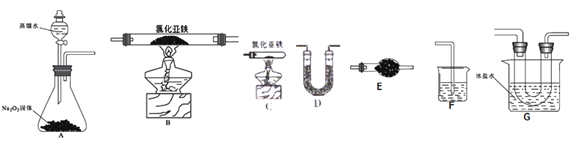
(2)实验装置的合理连接顺序为:A→____________→F。
(3)A装置中反应的化学方程式为________________。
(4)当加热装置中充分反应后,余下的固体是_________;本套实验装置的主要缺点是_____________。
(5)利用反应生成的FeCl3设计实验证明Fe(OH)3是弱碱,实验方案为____________。
【实验三】卤素化合物反应实验条件控制探究
(6)在不同实验条件下KClO3可将KI氧化为I2或KIO3。该小组设计了一系列实验来研究反应条件对反应物的影响,其中某一实验的数据记录如下(实验控制在室温下进行):
试管标号 | 1 | 2 | 3 | 4 |
0.20mol·L-1KI溶液/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0mol/L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①该组实验的目的是________________________。
②设计1号试管实验的作用是_______________________。
③若2号试管实验现象为“反应后溶液呈黄色”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。

根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为_________。
(2)在CH4、C2H2、CH3OH中,碳原子采取sp3杂化的分子有_____________。
(3)根据VSEPR理论预测ED4-离子的空间构型为_______。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子式为__________(写2种)___________。
(4)由A和D形成的原子个数为1∶1的化合物的电子式为___________。
(5)氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是一种橙黄色的液体,与水反应,并产生能使品红褪色的气体。下列说法错误的是_______

A.S2Cl2每个原子周围都满足8电子稳定结构
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2 结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2溶于水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑ +3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻且A与D同族,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C 位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号或其相应化学式表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为___________________。
(2)B的氢化物的空间构型为__________。
(3)E核外电子排布式是_______________,E的某种化合物的结构如下图所示,

微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有_______。
a.离子键 b.极性键 c.配位键 d.氢键
(4)A与B的气态氢化物的沸点_______更高,A与D的气态氢化物的沸点_______更高。
(5)A的稳定氧化物中,中心原子的杂化类型为_________,空间构型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生 C2H4 并检验 C2H4 性质的实验。请回答下列问题:
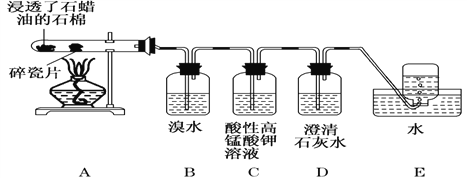
(1)C2H4的电子式:_________。
(2)B 装置中反应的化学方程式为:____________。
(3)C 装置中可观察到的现象是__________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________(填字母)中的实验现象可判断该资料是否真实。
(5)通过上述实验探究,除去甲烷中乙烯的方法是______。
A.气体通入水中
B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
某种烯烃与H2 1:1加成后的产物如图所示:则该烯烃的结构有_______种。
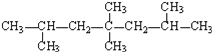
(6)苯和乙烯都是石油化工的重要原料,苯和溴反应的方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是某种新型药物的中间体,其合成路线如下:
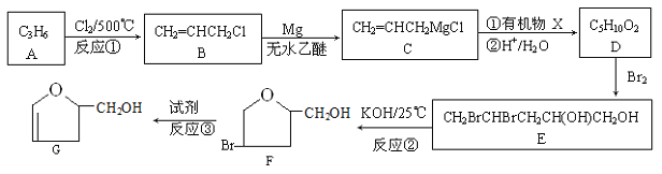
已知: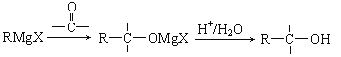
回答下列问题:
(1)F的质谱图中,最大质荷比的数值是___________;
(2)写出反应③所需要的试剂_______;反应②的反应类型是___________;
(3)有机物B中所含官能团的名称是__________;
(4)写出有机物X的结构简式__________;
(5)写出由E到F的化学方程式__________;
(6)A所有的链状二氯取代物同分体数目有__________种;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com