
【题目】下列各项中指定的比值是2∶1的是
A.金刚石晶体中C与C-C键的物质的量之比
B.K2S溶液中c(K+)与c(S2-)之比
C.Na2O2晶体中阳离子与阴离子的物质的量之比
D.H2SO3溶液中阳、阴离子数比
科目:高中化学 来源: 题型:
【题目】对工业废气进行脱硝有多种方法。
(1)用活性炭还原法处理氮氧化物的反应为C(s)+2NO(g)![]() N2(g)+CO2(g)。一定条件下按下表所示条件向体积固定的容器中充入物质发生该反应。
N2(g)+CO2(g)。一定条件下按下表所示条件向体积固定的容器中充入物质发生该反应。
容器 | 温度 | 体积 | C(s) | NO(g) | N2(g) | CO2(g) |
甲 | 600℃ | V L | 1mol | 2mol | 0 | 0 |
乙 | 600℃ | V L | 0 | 0 | 2mol | 2mol |
①下列能说明甲容器中反应达到平衡状态的是_______。
a.容器的压强保持不变 b.v(NO)正=2v(CO2)逆
c.混合气体的密度保持不变 d.NO、N2、CO2的物质的量之比为2∶1∶1
②关于平衡时的甲、乙两容器,下列说法一定正确的是_______。
a.p(甲)=p(乙) b.c(NO)甲=c(CO2)乙
c.2c(CO2)甲=c(N2)乙 d.体积分数φ(CO2)甲=φ(N2)乙
(2)氮氧化物与悬浮在大气中的海盐粒子相互作用生成亚硝酰氯(ClNO),涉及反应如下:4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1 ;2NO2(g)+NaCl(s)
2NaNO3(s)+2NO(g)+Cl2(g) K1 ;2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2;2NO(g)+Cl2(g)
NaNO3(s)+ClNO(g) K2;2NO(g)+Cl2(g)![]() 2ClNO(g) K3;则K1、K2 、K3之间的关系为K3=_______
2ClNO(g) K3;则K1、K2 、K3之间的关系为K3=_______
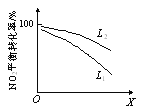
(3)利用O3进行如下脱硝反应:2NO2(g)+O3(g)![]() N2O5(g)+O2(g) ΔH<0。其他条件一定时,NO2(g)的平衡转化率随温度和压强的变化情况如下图甲所示。X表示_______(填“压强”或“温度”),L1_______L2(填“<”或“>”)。
N2O5(g)+O2(g) ΔH<0。其他条件一定时,NO2(g)的平衡转化率随温度和压强的变化情况如下图甲所示。X表示_______(填“压强”或“温度”),L1_______L2(填“<”或“>”)。
(4)用稀硝酸吸收NOx进行脱硝,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气不仅是新能源,也是重要的化工原料。
(1)氢气可由甲烷制备:CH4 (g)+H2O(l)![]() CO(g)+3H2 (g)ΔH=+250.1 kJ·mol-1,已知298 K时,CH4(g)、CO(g)的燃烧热分别为890 kJ·mol-1、283 kJ·mol-1。写出氢气燃烧热的热化学方程式___________。
CO(g)+3H2 (g)ΔH=+250.1 kJ·mol-1,已知298 K时,CH4(g)、CO(g)的燃烧热分别为890 kJ·mol-1、283 kJ·mol-1。写出氢气燃烧热的热化学方程式___________。
(2)利用反应CO(g)+2H2(g)![]() CH3OH(g) ΔH合成清洁能源CH3OH,CO的平衡转化率与温度的关系如图所示:
CH3OH(g) ΔH合成清洁能源CH3OH,CO的平衡转化率与温度的关系如图所示:
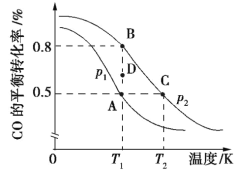
①该可逆反应的正反应ΔH______0; A、B、C三点平衡常数KA、KB、KC的大小关系是_____; 压强p1___p2(填“>”“<”或“=”); 在T1和p2条件下,由D点到B点过程中,正、逆反应速率之间的关系: v正___v逆(填“>”“<”或“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是_____________________ (填序号)。
a.CO物质的量保持不变
b.单位时间内消耗CO的浓度和生成甲醇的浓度相等
c.混合气体的压强不再变化
d.混合气体的密度不再变化
③在2 L恒容密闭容器中充入2 mol CO和4 mol H2,在p2 (和T2条件下经10 min达到平衡状态C点,在该条件下,v(CH3OH)=______________________;平衡常数K为_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在汽车尾气净化装置中,气体在催化剂表面吸附与解吸的过程如图所示。下列说法正确的是

A.N2 是氧化产物
B.NO 和O2 必须在催化剂表面才能反应
C.吸附过程发生化合反应,解吸过程发生分解反应
D.催化转化的总反应为2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①、②、③容积不等的恒容密闭容器中,均充入0.1molCO和0.2molH2,在催化剂的作用下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示。下列说法正确的是
CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示。下列说法正确的是
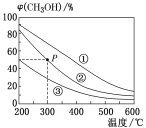
A.该反应的正反应为吸热反应
B.三个容器的容积:①>②>③
C.在P点,CO的转化率为75%
D.在P点,向容器②中再充入CO、H2及CH3OH各0.025mol,此时υ正(CO)<υ逆(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2 L Cl2溶于水,溶液中Cl-,ClO-和HClO的微粒数之和为NA
B.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.2NA
C.1 mol PC13与1 mol 36C12反应达到平衡时,产物中含P—36C1键数目为2NA
D.反应![]() +
+ ![]() →
→ ![]() +
+ ![]() 中,每生成294g
中,每生成294g ![]() 释放的中子数为3NA
释放的中子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元索对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 原于半径:r(Y)>r(Z)>r(W)
B. 化合物N、乙烯使溴水褪色的原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(相对分子质量为376)是一种氧气吸收剂,为红棕色晶体,潮湿时易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
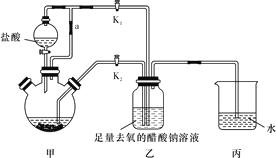
①待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
②将装置乙中混合物快速过滤、洗涤和干燥,称量得到 [Cr(CH3COO)2]2·2H2O。
③检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
④关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
(1)正确的实验步骤为:_________________。
(2)装置甲中连通管a的作用是_______________________________________。
(3)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为_______________________________________________。
(4)实现步骤①中溶液自动转移至装置乙中的实验操作为_______________________。
(5)步骤④目的是___________________________________________。
(6)洗涤产品时,依次用去氧的冷蒸馏水、无水乙醇、乙醚,目的是_________________。
(7)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 9.48g,则该实验所得产品的产率为____(不考虑溶解的醋酸亚铬水合物)(用百分数表示,保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A、υ(A)=0.5mol/(L·min) B、υ(B)=1.2mol/(L·s)
C、υ(C)=0.1mol/(L·s) D、υ(D)=0.4mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com