
����Ŀ����������������Դ��Ҳ����Ҫ�Ļ���ԭ�ϡ�
��1���������ɼ����Ʊ�:CH4 (g)+H2O(l)![]() CO(g)+3H2 (g)��H=+250.1 kJ��mol-1����֪298 Kʱ��CH4(g)��CO(g)��ȼ���ȷֱ�Ϊ890 kJ��mol-1��283 kJ��mol-1��д������ȼ���ȵ��Ȼ�ѧ����ʽ___________��
CO(g)+3H2 (g)��H=+250.1 kJ��mol-1����֪298 Kʱ��CH4(g)��CO(g)��ȼ���ȷֱ�Ϊ890 kJ��mol-1��283 kJ��mol-1��д������ȼ���ȵ��Ȼ�ѧ����ʽ___________��
��2�����÷�ӦCO(g)+2H2(g)![]() CH3OH(g) ����H�ϳ������ԴCH3OH��CO��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ:
CH3OH(g) ����H�ϳ������ԴCH3OH��CO��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ:
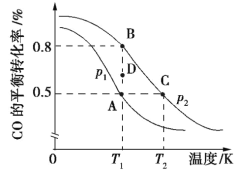
�ٸÿ��淴Ӧ������Ӧ��H______0�� A��B��C����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵ��_____�� ѹǿp1___p2(����>����<������=��)�� ��T1��p2�����£���D�㵽B������У������淴Ӧ����֮��Ĺ�ϵ: v��___v��(����>����<������=��)��
�����ں��º��������½���������Ӧ���ܱ�ʾ�ÿ��淴Ӧ�ﵽƽ��״̬����_____________________ (�����)��
a.CO���ʵ������ֲ���
b.��λʱ��������CO��Ũ�Ⱥ����ɼ״���Ũ�����
c.��������ѹǿ���ٱ仯
d.���������ܶȲ��ٱ仯
����2 L�����ܱ������г���2 mol CO��4 mol H2����p2 (��T2�����¾�10 min�ﵽƽ��״̬C�㣬�ڸ������£�v(CH3OH)=______________________��ƽ�ⳣ��KΪ_________________________________
���𰸡�H2(g)+![]() O2(g)
O2(g)![]() H2O(l)����H=-285.7 kJ��mol-1 < KA=KB>KC < > ac 0.05 mol��L-1��min-1 1 L2��mol-2
H2O(l)����H=-285.7 kJ��mol-1 < KA=KB>KC < > ac 0.05 mol��L-1��min-1 1 L2��mol-2
��������
��1������һ�����͵ĸ�˹���ɵ�Ӧ�ã������������������в������ɣ�
��2��������ͼ���Կ�������ѹǿһ��������£��¶�Խ�߷�Ӧ���ת����Խ�ͣ���Խ��Խ����Ӧ��������Ӧ�Ƿ��ȵģ����¶�һ��������£�p1��ת����û��p2�ߣ�����Ӧ��������������ٵģ����ѹǿԽ������Ӧ���е�Խ���ף���p2��ѹǿ����p1���ݴ����������ɣ�
��1���г�����ʽ�ӣ���![]() ����
����![]() ����
����![]() ���ٸ��ݸ�˹���ɣ���(�ڣ��٣���)��3�õ�
���ٸ��ݸ�˹���ɣ���(�ڣ��٣���)��3�õ�![]() ��
��
��2���ٴ�ͼ���п��Կ����������¶����ߣ�CO��ƽ��ת���ʽ��ͣ�˵������Ӧ�Ƿ��ȷ�Ӧ��Kֻ���¶��йأ�A��B�����¶���ͬ��K��ͬ��B��C����ѹǿ��ͬ����T1<T2�������¶ȣ�K��С����KA��KB>KC���¶���ͬ������ѹǿ��CO��ƽ��ת��������p1<p2��D�㵽B��(δƽ��״̬��ƽ��״̬)CO��ת������������Ӧ���ʴ����淴Ӧ���ʣ�
��a.CO�����ʵ������䣬��Ũ�Ȳ��䣬˵����Ӧ�ﵽƽ��״̬��a��ȷ��
b.��λʱ��������CO��Ũ�Ⱥ����ɼ״���Ũ�ȱ�Ȼ��ȣ�b����
c.��������ѹǿ���䣬˵�������ʵ�Ũ�Ȳ��䣬�ʷ�Ӧ�ﵽƽ��״̬��c��ȷ��
d.���������ܶ�ʼ�ղ��䣬�ܶȲ��䲻��˵����Ӧ�ﵽƽ��״̬��d����;
��ѡac��
����2 L�����ܱ������г���2 mol CO��4 mol H2����p2 (��T2�����¾�10 min�ﵽƽ��״̬C�㣬�ڸ������£�CO��ƽ��ת����Ϊ0.5����![]() ��CO�� H2����CH3OH��ƽ�ⳣ��Ũ�ȷֱ�Ϊ��0.5mol/L��1mol/L��0.5mol/L����ˣ�
��CO�� H2����CH3OH��ƽ�ⳣ��Ũ�ȷֱ�Ϊ��0.5mol/L��1mol/L��0.5mol/L����ˣ�![]() ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�Ŀ������ȶ�����������������Ҫ��Ӱ�졣800��ʱ��A��B��C���������ں����ܱ������з�Ӧʱ��Ũ�ȱ仯��ͼ��ʾ���ش��������⣺

(1)�÷�Ӧ����������________��
(2)2min�ڣ�C�ķ�Ӧ����Ϊ________��
(3)�÷�Ӧ�Ļ�ѧ����ʽΪ________��
(4)�����������£����A�ķ�Ӧ����Ϊ![]() ����ʱ�ķ�Ӧ������800��ʱ���_____��
����ʱ�ķ�Ӧ������800��ʱ���_____��
A.��800��ʱ�� B.��800��ʱ�� C.��800��ʱ����һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����SiO2�Ʊ��ߴ��ȹ�Ĺ�ҵ������ͼ��ʾ��

����˵���������
A. SiO2�봿�趼��Ӳ�ȴ��۷е�ߵľ���
B. XΪCO����
C. ��Ӧ�ڲ�����H2�뷴Ӧ�۲�����HCl����ѭ��ʹ��
D. ��Ӧ�٢ڢ۾�Ϊ�ڸ��������µķ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() �ֱ�ȡ����
�ֱ�ȡ����![]() �����Һ�������ԣ�
�����Һ�������ԣ�![]() �μ���ˮ�͵�����������ʼ������������Ϊȷ������Һ����ɣ�����ļ��鷽�����Լ���
�μ���ˮ�͵�����������ʼ������������Ϊȷ������Һ����ɣ�����ļ��鷽�����Լ���
A. ��ɫ��Ӧ B. NaOH��Һ�����ȣ�
C. ![]() �ữ
�ữ![]() ��Һ D.
��Һ D. ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Է�ӦA��B��AB��˵�������°�����������з�Ӧ��
��20 mL��Һ�к�A��B��0.01 mol
��50 mL��Һ�к�A��B��0.05 mol
��0.1 mol��L��1��A��B��Һ��10 mL
��0.5 mol��L��1��A��B��Һ��50 mL
���߷�Ӧ���ʵĴ�С��ϵ��
A.�ڣ��٣��ܣ���B.�ܣ��ۣ��ڣ���
C.�٣��ڣ��ܣ���D.�٣��ڣ��ۣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ���������ֵ��������������ȷ����
A.���³�ѹ�£�11.2 LNH3������ԭ����Ϊ2NA
B.��״���£�22.4 LCl2������ԭ����ΪNA
C.���³�ѹ�£�80 gSO3��������ԭ����Ϊ3NA
D.һ�������£�56 g��������HNO3��ȫ��Ӧ��ת�Ƶ�����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������۵���Ҫ��Ⱦ��ΪPM10��PM2.5��SO2��NO2��O3��CO��������
��1����������������NOx������������SO2���������ǻ�����ѧ�о����ȵ㡣
ѡ���Դ���ԭ������SCR����Ŀǰ�����������������������ڴ��������£��û�ԭ������NH3��ѡ���Ե���NOx��Ӧ����N2��H2O��
����֪��4NH3��g��+5O2��g��=4NO��g��+6H2O��g�� ��H=��905.5kJ/mol
N2��g��+O2��g��=2NO��g�� ��H= +180kJ/mol
��4NH3��g��+4NO��g��+O2��g��=4N2��g��+6H2O��g�� ��H=
���ڴ��������£�����[CO��NH2��2]Ҳ���Խ�NOx��Ӧ����N2��H2O��д��CO��NH2��2��NO2��Ӧ�Ļ�ѧ����ʽ ��
��2���绯ѧ���Ǻϳɰ���һ���·�������ԭ����ͼ1��ʾ�������ĵ缫��Ӧ�� ��
��3����̼��[n(NH3)/n(CO2)]�Ժϳ�����[2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)]��Ӱ�죬���º���ʱ���������ʵ���3 mol��NH3��CO2�Բ�ͬ�İ�̼�Ƚ��з�Ӧ�������ͼ2��ʾ��a��b�߷ֱ��ʾCO2��NH3��ת���ʱ仯��c�߱�ʾƽ����ϵ�����ص���������仯��[n(NH3)/ n(CO2)]= ʱ�����ز���������㣬ͼ��y= (��ȷ��0.01)��
CO(NH2)2(g)+H2O(g)]��Ӱ�죬���º���ʱ���������ʵ���3 mol��NH3��CO2�Բ�ͬ�İ�̼�Ƚ��з�Ӧ�������ͼ2��ʾ��a��b�߷ֱ��ʾCO2��NH3��ת���ʱ仯��c�߱�ʾƽ����ϵ�����ص���������仯��[n(NH3)/ n(CO2)]= ʱ�����ز���������㣬ͼ��y= (��ȷ��0.01)��
��4����ˮ�к���������Ĵ��������ж��֡�
���ô��������������������Եõ�N2H4��ϡ��Һ���÷�Ӧ�Ļ�ѧ����ʽ��__________��
����H2����ԭ���ɽ���ˮ��NO![]() ��Ũ�ȣ��õ��IJ����ܲ������ѭ������Ӧ����Һ��pH (����ߡ��������͡����䡱)��
��Ũ�ȣ��õ��IJ����ܲ������ѭ������Ӧ����Һ��pH (����ߡ��������͡����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����ָ���ı�ֵ��2��1����
A.���ʯ������C��C-C�������ʵ���֮��
B.K2S��Һ��c(K+)��c(S2-)֮��
C.Na2O2�������������������ӵ����ʵ���֮��
D.H2SO3��Һ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Na2MoO4)�����ؽ����β�����������ĿǰӦ�ý϶��һ������ˮ�����������þ����![]() ��Ҫ�ɷ���MoS2��������PbS��
��Ҫ�ɷ���MoS2��������PbS��![]() ����ȡ�����ƾ���Ĺ�����������ͼ��ʾ��
����ȡ�����ƾ���Ĺ�����������ͼ��ʾ��
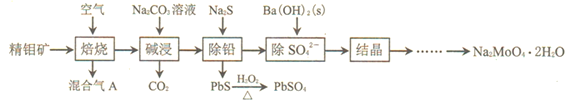
��ش��������⣺
�Ż����A�к���һ�ִ�����Ⱦ��仯ѧʽΪ___________��
�Ʊ��յĹ����в�����ͼ1��ʾ�������������������
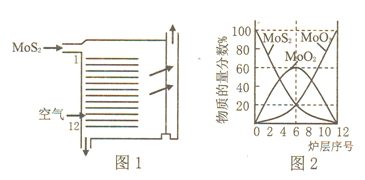
�ٶ���������յ��ŵ���___________![]() �δ�����
�����![]() ��
��
��������ͼ2��д����6��12��MoO2�μӷ�Ӧ�Ļ�ѧ����ʽ___________��
��д�����ʱ������Ӧ�����ӷ���ʽ___________��
��PbS��H2O2��Ӧʱ���¶ȸ���40����Ӧ���ʷ���������ԭ����___________��
������ͼ������SO42�����Ĺ����У���BaMoO4��ʼ����ʱ��SO42����ȥ����Ϊ97.0%����֪ԭNa2MoO4��Һ��c(MoO42��)=0.48mol/L�� c(SO42��)=0.040mol/L��Ksp(BaSO4) = 1.0��10-10����Ksp(BaMoO4) = ___________��![]() ��������Һ����仯���Բ���
��������Һ����仯���Բ���![]()
��﮺Ͷ������γɵĶ��ε�ص��ܷ�ӦΪ��xLi + nMoS2![]() Lix(MoS2)n�����طŵ�ʱ��������Ӧʽ��___________��
Lix(MoS2)n�����طŵ�ʱ��������Ӧʽ��___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com