
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2 L Cl2溶于水,溶液中Cl-,ClO-和HClO的微粒数之和为NA
B.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.2NA
C.1 mol PC13与1 mol 36C12反应达到平衡时,产物中含P—36C1键数目为2NA
D.反应![]() +
+ ![]() →
→ ![]() +
+ ![]() 中,每生成294g
中,每生成294g ![]() 释放的中子数为3NA
释放的中子数为3NA
【答案】D
【解析】
A选项,标准状况下,11.2 L Cl2物质的量为0.5mol,氯气与水反应是可逆反应,根据物料守恒得出溶液中Cl-,ClO-和HClO的微粒数之和小于NA,故A错误;
B选项,32.5 g FeCl3物质的量为0.2mol,其水解形成Fe(OH)3胶体,胶体粒子是聚合体,因此胶体粒子数小于0.2NA,故B错误;
C选项,1 mol PC13与1 mol 36C12反应达到平衡时,反应是可逆反应,产物PC15的物质的量小于1mol,因此PC15中含P—36C1键数目小于为2NA,故C错误;
D选项,根据反应式知x=3,即反应![]() +
+ ![]() →
→ ![]() +
+ ![]() 中,每生成294g
中,每生成294g ![]() 即1mol,则释放的中子数为3NA,故D正确;
即1mol,则释放的中子数为3NA,故D正确;
综上所述,答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X的质谱图:
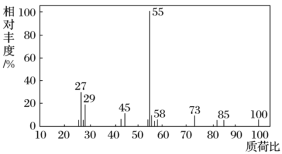
有机物X的相对分子质量是__________。
(2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。有机物X的分子式是________________。
(3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3∶1。有机物X的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.常温常压下,11.2 LNH3所含的原子数为2NA
B.标准状况下,22.4 LCl2所含的原子数为NA
C.常温常压下,80 gSO3所含的氧原子数为3NA
D.一定条件下,56 g铁与足量HNO3完全反应,转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为探究和比较二氧化硫和氯水的漂白性,设计了如图所示的实验装置。
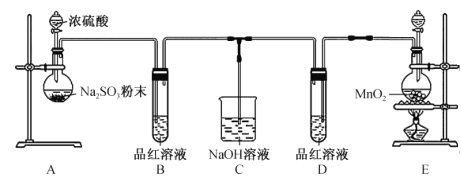
回答下列问题:
(1)装置A中反应的化学方程式为____________________________________;制备SO2时选用浓硫酸而不用稀硫酸的主要原因是 ____________________________。
(2)实验室用装置E制备C12,反应的离子方程式为 __________________________。若有8.7gMnO2参加反应,则转移的电子的物质的量为 ______________。
(3)反应开始一段时间后,观察到装置B、D中的品红溶液出现的现象是____________。
(4)小组中甲同学认为SO2和氯水都有漂白性,若二者混合使用,漂白性会更强。为验证甲同学的推断,在同温同压下,他们同时将SO2和C12等体积通入到品红溶液中,结果发现品红溶液_____________(填字母)。
a.很快褪色 b.几乎不褪色 c.先褪色后复原
出现上述现象的原因是________________________________ (用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中指定的比值是2∶1的是
A.金刚石晶体中C与C-C键的物质的量之比
B.K2S溶液中c(K+)与c(S2-)之比
C.Na2O2晶体中阳离子与阴离子的物质的量之比
D.H2SO3溶液中阳、阴离子数比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其制备途径及性质如图所示(假设恰好完全反应)。下列说法正确的是
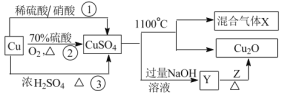
A.途径①所用混酸中,H2SO4与 HNO3物质的量之比为2:3
B.1molCuSO4在 1100℃所得混合气体中,O2为 0.75mol
C.Z 只能是葡萄糖
D.相对于途径①、③,途径②更好地体现了绿色化学思想
查看答案和解析>>
科目:高中化学 来源: 题型:
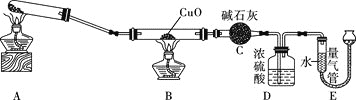
【题目】某活动小组在实验室探究氨气的的制备方法,并测定其分子组成。
![]() 同学甲用下图所示装置制备氨气。
同学甲用下图所示装置制备氨气。
已知:加热![]() 和
和![]() 饱和溶液可以制取
饱和溶液可以制取![]() 。
。
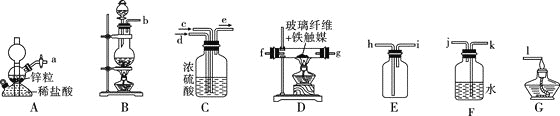
(1)![]() 、D、G处的酒精灯最先点燃的是 ___________
、D、G处的酒精灯最先点燃的是 ___________![]() 填字母
填字母![]() 。
。
(2)写出B中制取![]() 的反应的离子方程式:__________。
的反应的离子方程式:__________。
(3)图示装置从左到右正确连接顺序:![]()
![]() ____
____![]() ____
____![]() ____
____![]() ____
____![]() 。
。
![]() 同学乙用下图所示装置
同学乙用下图所示装置![]() 夹持装置已省略
夹持装置已省略![]() 制备氨气,并与CuO反应测定氨气的组成。
制备氨气,并与CuO反应测定氨气的组成。
(1)同学乙在相同条件下,选择不同固体试剂制取氨气,实验数据如下:
实验方案 | 固体试剂 |
| |
1 |
|
| 1753 |
2 |
| 1892 | |
3 |
|
| 1354 |
4 |
| 1384 | |
分析表中数据,你认为哪种方案制取氨气的效果最好?________![]() 填序号
填序号![]() ,该方案制取氨气效果好的可能原因是_______________。
,该方案制取氨气效果好的可能原因是_______________。
(2)装置D的作用是______________________________________。
(3)实验结束后,若测得干燥管C增重![]() ,装置E中气体的体积为
,装置E中气体的体积为![]() 已折算为标准状况
已折算为标准状况![]() ,则氨分子中氮、氢的原子个数比为___________
,则氨分子中氮、氢的原子个数比为___________![]() 用含m、V的代数式表示
用含m、V的代数式表示![]() ;若测量时,发现E装置中液面左低右高,则测得的比值___________
;若测量时,发现E装置中液面左低右高,则测得的比值___________![]() 填“偏大”“偏小”或“不变”
填“偏大”“偏小”或“不变”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组为探究![]() 漂白性的原因进行如下实验。已知
漂白性的原因进行如下实验。已知![]() 易溶于水,能溶于乙醇。
易溶于水,能溶于乙醇。![]() 的水溶液中存在下列平衡:
的水溶液中存在下列平衡:
![]()
![]() ;
;
![]()
![]() 。
。
实验室用亚硫酸钠粉末与硫酸制取![]() ,装置如图
,装置如图![]() 气密性良好
气密性良好![]() 。
。

(1)盛装![]() 的硫酸的仪器名称是________。使用
的硫酸的仪器名称是________。使用![]() 的硫酸比用
的硫酸比用![]() 的硫酸反应效果好,其原因是________。装置B的作用是________。
的硫酸反应效果好,其原因是________。装置B的作用是________。
(2)第一次实验:
C装置中混合溶液 | 品红的水溶液 | 品红的乙醇溶液 |
实验现象 | 红色褪去 | 无变化 |
从上述实验可知使品红水溶液褪色的微粒可能为________![]() 写出两种即可
写出两种即可![]() 。
。
(3)实验小组为进一步探究![]() 是使品红水溶液褪色的原因之一,进行第二次实验:取与第一次实验等体积等浓度的品红水溶液于装置C中,再加入少量NaOH固体,品红水溶液无明显变化,然后通入
是使品红水溶液褪色的原因之一,进行第二次实验:取与第一次实验等体积等浓度的品红水溶液于装置C中,再加入少量NaOH固体,品红水溶液无明显变化,然后通入![]() 气体,C装置中品红水溶液褪色。以上实验______
气体,C装置中品红水溶液褪色。以上实验______![]() 填“能“或“不能”
填“能“或“不能”![]() 证明
证明![]() 是使品红溶液褪色的原因之一,试用离子方程式说明理由:________。
是使品红溶液褪色的原因之一,试用离子方程式说明理由:________。
(4)请你设计探究![]() 是使品红水溶液褪色的原因之一的实验方案:________。
是使品红水溶液褪色的原因之一的实验方案:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH![]() C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
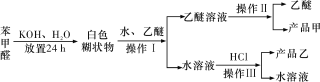
根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com