
����Ŀ����ѧ������ѧϰ��ѧ����Ҫ���ߡ�����������ʾ���ʱ仯�Ļ�ѧ�����У�����ȷ����( )
A. ���ˮ�еμ�FeCl3��Һ�Ʊ�Fe(OH)3���壺Fe3+��3H2O![]() Fe(OH)3�����壩��3H+
Fe(OH)3�����壩��3H+
B. ����ˮ������ӷ���ʽ�� Al3++ 3 H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
C. ��ʯī���缫����Ȼ�����Һ��2Cl����2H2O![]() 2OH����H2����Cl2��
2OH����H2����Cl2��
D. ������ˮ��Һ�еĵ��뷽��ʽ��H2S + H2O![]() HS- + H3O+
HS- + H3O+

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A. ��Ȼ���й�������̬�ͻ���̬������ʽ����
B. ���������нᾧ�κ��������ִ�����̬
C. ʯӢ��ˮ������觶��ǽᾧ�ε�
D. ���εĶ���������Ҫ�����ڹ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѹ���ʻ�������������ԭ��Ϊ��Ni(s)+4CO(g)![]() Ni(CO)4(g)��230��ʱ���÷�Ӧ��ƽ�ⳣ��K=2��105����֪��Ni(CO)4�ķе�Ϊ42.2�����������ʲ����뷴Ӧ��
Ni(CO)4(g)��230��ʱ���÷�Ӧ��ƽ�ⳣ��K=2��105����֪��Ni(CO)4�ķе�Ϊ42.2�����������ʲ����뷴Ӧ��
��һ�Σ���������CO��Ӧת������̬Ni(CO)4��
�ڶ��Σ�����һ�η�Ӧ���������������������230���Ƶøߴ�����
�����ж���ȷ����
A. ����c(CO)��ƽ���������ƶ�����Ӧ��ƽ�ⳣ������
B. ��һ�Σ���30����50������֮��ѡ��Ӧ�¶ȣ�ѡ50��
C. �ڶ��Σ�Ni(CO)4�ֽ��ʽϵ�
D. �÷�Ӧ�ﵽƽ��ʱ��v����[Ni(CO)4]=4v����(CO)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������岻��ȱ�ٵ�Ԫ�أ�Ϊ�˷�ֹ��ȱ���������г�������һ�ּӵ��Σ������ھ���������һ������KIO3��ȥ��ij�о�С��Ϊ�˼��ij�ӵ������Ƿ��е⣬�������йص����ϣ���������ԭ���ǣ�����Һ��KIO3+5KI+3H2SO4�T3I2+3H2O+3K2SO4
��1����д�����ӷ�Ӧ����ʽ����˫���ű�ʾ�÷�Ӧ�е���ת�Ƶķ������Ŀ���÷�Ӧ�����������뻹ԭ������������� �� 21.4gKIO3�μӷ�Ӧʱת�Ƶ���mol
��2��ʵ����������I2��K2SO4��Һ���õ��Լ���
A��Na2SO4��Һ B���ƾ� C�� CCl4 D��ʳ��ˮ
���õķ��뷽���� �� ���õIJ��������� �� ����ʲô�������ȷ����ʳ���к��� ��
��3������ʵ�����õ�һ�����ʵ���Ũ�ȵ�ϡ���ᣬ������0.5mol/L��ϡ������Һ450mL������98%��Ũ���ᣨ���ܶ�Ϊ1.84g/cm3��mL����������Ҫ�õ�����Ҫ���������ǣ�����ţ� ��
A��100mL��Ͳ B��������ƽ C�������� D��100mL����ƿ
E��50mL ��Ͳ F����ͷ�ι� G���ձ� H��500mL����ƿ
��4����������������ϡ������ҺŨ��ƫ�ߵ���
A.�ܽ��ʱ����Һû����ȴ�����¾�ת��
B.ת��ʱû��ϴ���ձ���������
C.������ƿ��ˮ����ʱ�۾�����Һ��
D.����Ͳ��ȡŨ�����ϴ����Ͳ����ϴ��Һת�Ƶ�����ƿ
E.ҡ�Ⱥ���Һ����ڿ̶��ߣ��ּ�����ˮ���̶��ߣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.1mol H2O������Ϊ18g/mol
B.CH4��Ħ������Ϊ16g
C.3.01��1023��SO2���ӵ�����Ϊ32g
D.��״���£�1mol�κ����������Ϊ22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ܸ�ʴ������25���£���20mL0.2molL-1��������еμ�0.2molL-1��NaOH��Һʱ����Һ��pH�仯��ͼ��ʾ��
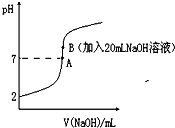
��֪������ȣ������͵���ƽ�ⳣ����K��һ�������������������������ϡ��Һ�еĵ���������![]()
��ش��������⣺
��1����������ϡ��Һ�У�ͨ���ı�����������ʹ�����ĵ����[![]() (HF)]�������_______����ʹ�����ĵ���ƽ�ⳣ��[Ka(HF)] �������_____________��
(HF)]�������_______����ʹ�����ĵ���ƽ�ⳣ��[Ka(HF)] �������_____________��
a�������¶� b������Һ�е���2��Ũ���� c����������NaF���� d.��ˮ
��2���ڴ��¶��£������ĵ���ƽ�ⳣ��Ka(HF)Ϊ��_____���������(HF)Ϊ______%��
��3�������й�ͼ�и�����Ũ�ȹ�ϵ��ȷ����________��
a����A����Һ�У�c(F��)+c(HF)=0.2 molL-1
b����B����Һ�У�c(H+)+c(HF)= c(OH��)
c����B����Һ�У�c(Na+)��c(F��)��c(H+)��c(OH��)
d����A��B����Һ�ж����ϣ�![]() = Ka(HF)
= Ka(HF)
��4������������Һ�еμ�10mlNaOH��Һ���뽫HF��������Һ�е�����Ũ��һ��Ӵ�С���� ___________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ�г���X�����о�����ṹ����һ����ɫ����ɱ�ʾΪ��MxFey��CN��z �� �о��������Ľṹ������Fe2+��Fe3+�ֱ�ռ��������Ķ��㣬�����������ڣ���CNһλ������������ϣ��侧���е������ӽṹ��ͼʾ������˵����ȷ���ǣ� �� 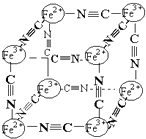
A.�þ�����ԭ�Ӿ���
B.M������λ����������������ģ���+2��
C.M������λ����������������ģ���+1�ۣ���M+��ȱ�ʣ�������û��M+��ռ�����ĵİٷֱȣ�Ϊ50%
D.����Ļ�ѧʽ�ɱ�ʾΪMFe2��CN��3 �� ��MΪ+1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɽ�������PCL�Ľṹ�ɱ�ʾΪ ![]() ����ϳ�·�����£�
����ϳ�·�����£� 
��֪��
�� ![]()
��R��CH=CH��CH3 ![]() R��CH=CH��CH2Br
R��CH=CH��CH2Br
�� ![]()
�ش��������⣺
��1���ɱ�������B�ķ�Ӧ�Լ�������Ϊ
��2��D�Ľṹ��ʽ�� �� ��������D�ķ�Ӧ������ ��
��3��PCL����������͡������͡����߷��Ӳ��ϣ� ��D������ͬ�����ŵ�ͬ���칹��E�����кϳ�·�߿�ת��ΪD��![]()
��4��E�Ľṹ��ʽ�� ��
��5����H����K�Ļ�ѧ����ʽ�� ��
��6��M���������Z�����Ǻϳ�������ԭ��֮һ����B��ԭ��������Ӧ���Ƶü����ᣮ B��W��X��������
д��W��X�Ľṹ��ʽ��W��X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧ����ȥ�����Ȼ����л��е��Ȼ��ƣ����������ʵ�鷽���ش����⣮ 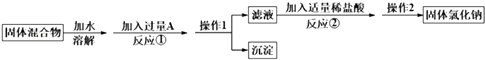
��1��A���ʵĻ�ѧʽΪ������1�������� ��
��2����Ӧ���м����Թ�����A���ʵ�Ŀ�������ж�A�ѹ�����ʵ����������� ��
��3��д����Ӧ�ڵĻ�ѧ����ʽ�� �� ����������������������õ����Ȼ��ƵĴ�������С���û�С���Ӱ�죮
��4��ʵ��ʱ��ȡ��Ʒ������Ϊ185.0g����������1��ó�����������ˮ��������Ϊ50.0g������Ʒ��NaCl������������ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com