
【题目】下列不是应用了电解池原理的是( )
A. 电镀 B. 工业制镁 C. 牺牲阳极的阴极保护法 D. 氯碱工业制Cl2等
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】黄铜矿是一种重要的化工原料,主要成分是CuFeS2,另外还有少量的氧化铝、二氧化硅及水分,通过化学工艺可获得许多化工产品。
(1)铜元素位于元素周期表中_________(填写周期、族);基态Fe原子的价层电子轨道表达式为_____;
(2)硫位于第VIA 族,该族元素氢化物沸点由低到高的顺序及原因是_________(必要化学用语及文字简答)。
(3)基态氮原子的第一电离能大于氧原子的第一电离能的原因是__________。
(4)由铝和氯元素组成的化合物熔点190℃、在熔融态不导电;该化合物易升华,其蒸气密度是相同条件下氢气的133.5倍。请写出其蒸气分子的结构式______________(如有配位键,请 用“→”表 示 )。(5)黄铜矿在空气中高温灼烧可以得到固体混合物和废气,固体混合物中有X和Y两化合物。固体化合物X的晶胞模型如图甲所示:
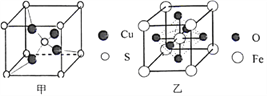
①化合物X的化学式:___________;
②废气中SO2经催化氧化生成SO3,SO3分子中硫原子杂化方式为___________;SO3分子空间构型是___________。
(6)黄铜矿高温灼烧得到的另一固体化合物Y的晶胞模型如图乙,已知丫晶体密度为ρg/cm3,则Y 晶体中晶胞边长是_____cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种有机物有如下转化关系。已知B可以发生银镜反应,D气体密度是氢气的14倍。
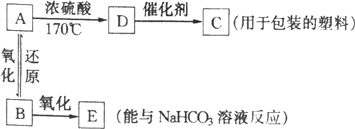
根据图示,
(1)试写出A、C、E的结构简式:A_____、C_______、E________。
(2)写出下列反应的化学方程式:
A→D:_______________________;
A→B: _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明上次考试化学没考好,很沮丧。班主任杜老师开导他说:学习化学一是要有兴趣;二是要做好归纳总结、发现规律,同时还要对特殊情况适当记忆;三是要重视基础,抓住问题的本质。听了老师的话,小明总结了刚学习过的内容,你认为正确的是( )
①由非金属元素组成的化合物一定是共价化合物
②离子化合物一定含离子键,也可能含共价键
③共价键既可能存在于单质和共价化合物中,也可能存在于离子化合物中
④金属性越强的元素相应的简单阳离子氧化性一般越弱
⑤含金属元素的化合物不一定是离子化合物
⑥任何元素的原子都是由核外电子和核内中子、质子组成的
⑦化学反应一定伴随着能量的变化
⑧质子数相同的微粒一定属于同种元素
A. ②③④⑤⑦ B. ②③⑤⑦⑧ C. ①③④⑥⑦ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知:A、B同周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是 D原子最外层电子数的3倍。试回答:
(1)写出元素的名称:A________、C________。
(2)写出由B、D组成的两种化合物的电子式分别为:_______、_______。
(3)C的固态氧化物属于_______晶体,写出表示C的氧化物的一种重要的工业用途_______。
(4)A、C的最高价氧化物对应水化物中酸性较强的是_______ (写水化物的分子式)。
(5)写出C的氧化物与D的最高价氧化物对应水化物反应的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为原电池示意图,回答下列问题:
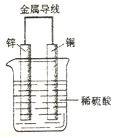
(1)该装置能够将_________能转化成电能。
(2)锌是原电池的_______极,放电过程中____(填“得”或“失”)电子,发生_______反应。
(3)电子是由_______极通过导线流向________极。
(4)铜电极的电极的反应式为____________________
(5)总反应的化学方程式为_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(1)T℃时,在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。

①反应2min到5min,用氢气表示的平均反应速率v(H2)=_____________。
②下列说法正确的是_____________(填字母序号)。
A.达到平衡时,CO的转化率为50%
B.5min后容器中压强不再改变
C.达到平衡后,再充入氩气,反应速率增大
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
E.加入催化剂可以加快化学反应速率,同时提高CO和H2平衡的转化率
③下列叙述可以说明该反应在该条件下已经达到化学平衡的是__________(填字母序号)。
A.混合气体密度不发生改变 B.混合气体的平均相对分子质量不再发生改变
C.v(CO)正=2v(H2)逆 D.n(CO)与n(H2)的比值不变
(2)某温度下,在一容积可变的恒压密闭容器中分别充入1molCO和1.2molH2,达到平衡时容器体积为2L,且含有0.5molCH3OH(g),则该反应平衡常数的值为_______,此时向容器中再通入0.3molCO和0.3mo1CH3OH(g),则此平衡将______________(填“向正反应方向”、“不”或“向逆反应方向”)移动。
(3)若压强、投料比x=n(CO)/n(H2)对反应的影响如图二所示,则图中曲线所示的压强关系:p1_____p2(填“=”“>”或“<”)。
(4)工业上另一种合成甲醇的方法是利用CO2和H2,已知:CH3OH、H2的燃烧热(△H)分別为-726.9kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
Ⅰ.丙烷(C3H8)是一种优良的燃料,下图是一定量丙烷完全燃烧生成CO2和1molH2O(I)过程中的能量变化图。试回答下列问题:
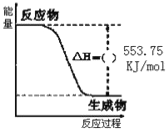
(1)写出丙烷燃烧的热化学方程式:__________。
(2)二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ的热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ的热量,则混合气体中丙烷和二甲醚的物质的量之比为__________。
Ⅱ.用下图所示的装置进行中和热的测定实验,分别取50mL0.55mol/L的NaOH溶液、50mL0.25mol/L的硫酸进行实验,回答下列问题:

(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是__________。
(2)近似认为0.55mol/L的NaOH溶液和0.25mol/L的硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃),通过以下数据计算中和热△H=__________(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)若改用60mL0.25mol/L的H2SO4和50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”或“不相等”)。
(4)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)_____。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.将以上四实验测量温度均纳入计算平均值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com