
【题目】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
Ⅰ.丙烷(C3H8)是一种优良的燃料,下图是一定量丙烷完全燃烧生成CO2和1molH2O(I)过程中的能量变化图。试回答下列问题:
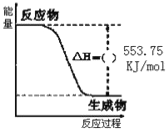
(1)写出丙烷燃烧的热化学方程式:__________。
(2)二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ的热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ的热量,则混合气体中丙烷和二甲醚的物质的量之比为__________。
Ⅱ.用下图所示的装置进行中和热的测定实验,分别取50mL0.55mol/L的NaOH溶液、50mL0.25mol/L的硫酸进行实验,回答下列问题:

(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是__________。
(2)近似认为0.55mol/L的NaOH溶液和0.25mol/L的硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃),通过以下数据计算中和热△H=__________(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)若改用60mL0.25mol/L的H2SO4和50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”或“不相等”)。
(4)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)_____。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.将以上四实验测量温度均纳入计算平均值
【答案】 C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2215.0kJ/mol 1∶3 环形玻璃棒 未将小烧杯和大烧杯杯口保持相平 -56.8kJ/mol 不相等 abc
【解析】
Ⅰ.(1)根据图像可知生成1mol液态水放出的热量是553.75kJ,则1mol丙烷完全燃烧生成4mol水放出的热量是4×553.75kJ=2215.0kJ,因此丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2215.0kJ/mol。
(2)设混合气体中丙烷和二甲醚的物质的量分别是xmol、ymol,则x+y=1,1455y+2215x=1645kJ,解得x=0.25、y=0.75,因此混合气体中丙烷和二甲醚的物质的量之比为1∶3;
Ⅱ.(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;为了减少热量的损失,大烧杯杯口与小烧杯杯口应该相平、小烧杯口用硬纸板盖住;
(2)第一次测定温度差为:(29.5-26.1)℃=3.4℃;第二次测定的温度差为:(32.3-27.2)℃=5.1℃;第三次测定的温度差为:(29.2-25.9)℃=3.3℃;第四次测定的温度差为:(29.8-26.3)℃=3.5℃,其中第二次的温度差误差较大,应该舍弃,其它三次温度差的平均值为:(3.4+3.3+3.5)/3℃=3.4℃。50mL0.55mol/L氢氧化钠与50mL0.25mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:100mL×1g/mL=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为:Q=mc△T=100g×4.18J/(g℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-1.4212kJ/0.025mol=-56.8 kJ/mol;
(3)反应放出的热量和所用酸以及碱的量的多少有关,若改用60mL0.25mol/L的H2SO4和50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量增加,因此与上述实验相比,所放出的热量不相等;
(4)a.实验装置保温、隔热效果必须好,否则放出的热量偏小,a正确;
b.用温度计测定NaOH溶液起始温度后,要将温度计回零后再测定H2SO4溶液的温度,否则放出的热量偏小,b正确;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,否则会导致较多热量散失,放出的热量偏小,c正确;
d.根据以上分析可知将以上四次实验测量温度均纳入计算平均值会导致反应放出的热量偏多,d错误。
答案选abc。


科目:高中化学 来源: 题型:
【题目】下列有关焰色反应的叙述中正确的是
A.只有金属的化合物灼烧时才会有不同的焰色
B.每次实验后,铂丝都要用水洗净
C.若透过蓝色钴玻璃只看到紫色,说明样品中含K元素而不含Na元素
D.若样品灼烧呈黄色,判断一定有Na元素,但不能排除含其他金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | M | R | Q | U | |
原子半径( | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | 0.82 | |
主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | +3 | |
最低负价 | -1 | -3 | -2 | |||||
下列说法错误的是( )
A. 元素X和Q形成的化合物中不可能含有共价键
B. X、Z、R的最高价氧化物的水化物之间可两两相互反应
C. R3-比Q2-更容易失去电子
D. M(OH)2的碱性比XOH的碱性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | 淀粉-KI 溶液 | 氧化性:Cl2>I2 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,

下列说法或表示式正确的是
A. 石墨和金刚石的转化是物理变化
B. C(s、石墨)===C(s、金刚石)ΔH =+1.9kJ·mol-1
C. 金刚石的稳定性强于石墨
D. 断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的离子方程式正确的是
A. 实验室制取Cl2时,用NaOH溶液吸收尾气:Cl2 + 2OH- =ClO-+ Cl-+H2O
B. 向FeCl3溶液中加入Fe粉,溶液变为浅绿色:Fe3+ + Fe =2Fe2+
C. 铜片放入稀HNO3中生成气体:Cu + 4H+ +2NO![]() =Cu2+ + 2NO2↑+2H2O
=Cu2+ + 2NO2↑+2H2O
D. Ba(OH)2溶液与稀H2SO4反应生成白色沉淀:Ba2+ + SO42- + H+ +OH- =BaSO4↓ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Br-、Cl-、CrO42- B. Cl-、Br-、CrO42-
C. CrO42-、Br-、Cl- D. Br-、CrO42-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com