
下列关于离子的叙述正确的是
A.在c(H+)=1×10-13mol·L-1的溶液中:Na+、Fe3+、Cl-、SO42-能大量共存
B.铜溶于FeCl3溶液中:Cu + Fe3+ = Fe2+ + Cu2+
C.NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.向溶液中加入BaCl2溶液后再加盐酸,有白色沉淀,说明该溶液中一定含有SO42-
C
【解析】
试题分析:A、在c(H+)=1×10-13mol·L-1的溶液中:Fe3+不能大量共存,错误;B、铜溶于FeCl3溶液中,离子方程式为Cu+2Fe3+=2Fe2++Cu2+,错误;C、根据物料守恒可知NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),正确;D、向溶液中加入BaCl2溶液后再加盐酸,有白色沉淀,说明该溶液中可能含有SO42-,也可能含有Ag+,错误;故本题选择C。
考点:离子的共存,离子方程式的书写,离子浓度的比较,离子的检验
考点分析: 考点1:离子共存 考点2:盐类水解 试题属性

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:填空题
(12分)已知:2X(g)+Y(g) a Z(g),T1温度时,在体积为2L的密闭容器中充入6mol X和2 mol Y,根据图示回答:
a Z(g),T1温度时,在体积为2L的密闭容器中充入6mol X和2 mol Y,根据图示回答:

(1)a=__;用X的浓度变化表示从反应开始到平衡时的平均反应速率为 mol/(Lmin)。
(2)平衡时,Y在混合物中的物质的量分数是 。
(3)下列选项能说明反应达到平衡状态的是 (选填字母)。
A.容器内压强保持不变
B.容器内密度保持不变
C.X的物质的量不再变化
D.υ(X)正 =υ(Z)逆
(4)其他条件相同时,若升高温度到T2时,反应的平衡常数为1,下列措施可以提高Y的转化率的是 (选填字母)。
A.选择适当的催化剂 B.分离出Z
C.增大压强 D.升高温度
(5)X、Y、Z由C、H、O三种元素中的一种或几种组成,信息如下:
物质 | X | Y | Z |
所含元素种数 | 1 | 2 | 3 |
分子中的电子总数 | 大于10 | 18 | |
燃烧热(kJ/mol) | -285.8 | -283 | -726.5 |
①则Z的分子式为___________。
②根据燃烧热数据分析,等质量的X、Y、Z充分燃烧,放出热量最多的是__________(填分子式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市海淀区高三年级3月适应性训练理综化学试卷(解析版) 题型:实验题
(15分)某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:

已知:有关金属离子生成氢氧化物沉淀所需的pH如下图:

(1)滤渣1的主要成分为 。
(2)电解脱铜:金属铜在 极析出。
(3)①用离子方程式解释加入H2O2的作用 。
②加Na2CO3调节溶液的pH至5,则滤渣2的主要成分为 。
(4)从滤液2中获得NiSO4.6H2O的实验操作是 、过滤、洗涤、干燥。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理示意图如下:

①A极的电极反应式为 和2H++2e-=H2↑。
②B极附近pH会 (填“增大”、“减小”或“不变”);用平衡移动原理解释B极附近pH变化的原因: 。
③若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),理论上能得到Ni g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三下学期开学初检测试卷理综化学试卷(解析版) 题型:选择题
下述实验操作不能达到实验目的的是
编号 | 实验目的 | 实验操作 |
A | 验证SO2具有漂白性 | 将SO2通入品红溶液中,品红溶液褪色 |
B | 验证Fe2+的还原性 | FeCl2溶液中加入酸性KMnO4溶液,KMnO4溶液褪色 |
C | 检验尿液中是否含有葡萄糖 | 在尿液中加新制的Cu(OH)2悬浊液加热至沸腾 |
D | 验证Na2CO3溶液中存在水解平衡 | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:填空题
(20分)近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。

则p1、p2、p3、p4由大到小的顺序 ,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H1=-574kJ·mol-1
CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ·mol-1
CH4(g) + 2NO2 (g) = N2(g) + CO2(g) + 2H2O(g) △H3
则△H3= ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=__________(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。
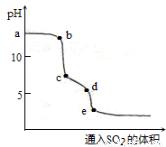
①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三第一次模拟考试理科综合化学试卷(解析版) 题型:实验题
(20分)下图是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。

(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先____,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹l,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时还可能产生的现象是________;从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。请写出产生白烟的化学方程式:________,迅速产生倒吸的原因是________。
(6)为了汪明一水合氨是弱碱,甲、乙两同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.l mol/L氨水pH为10,则认定一水合氨是弱电解质,理由是________。
②乙同学取出10 mL 0.1 mol/L氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是________,则证明一水台氨是弱电解质。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三第一次模拟考试理科综合化学试卷(解析版) 题型:选择题
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液在阴极上依次析出Cu、Fe、Al
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,再将上层液体从上口倒出
B.用镊子夹取金属钠固体,切割取用后剩余的钠放回原试剂瓶中
C.用标准浓度的盐酸滴定未知浓度 NaOH溶液时,酸式滴定管用蒸馏水洗净后未用同浓度盐酸润洗,将导致测定结果偏低
D.溶液配制、中和滴定实验中,容量瓶、锥形瓶用蒸馏水洗净后即可使用;而滴定管、移液管用蒸馏水洗净后,须再用待装液润洗2~3 次后方可使用
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省稳派教育高三一轮复习质量检测理科综合化学试卷(解析版) 题型:填空题
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。

(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为 。
②反应B+A→C的离子方程式为 。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D为 (填化学式),此时图b中x 7(填“﹥”“﹤”“﹦”)
②若图c符合事实,则其pH变化的原因是 (用离子方程式表示);已知图c中y﹤7,B的焰色反应为黄色,则B溶液中各离子浓度由大到小的顺序是 。
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com