
【题目】下列关于各金属及其化合物的说法正确的是( )
A. 已知 CCl4 不可燃,故少量的 Na 可保存在 CCl4 液体中
B. 金属铝既可与酸反应也可与碱反应,故铝是两性金属
C. 明矾为金属铝的化合物,可用作净水剂
D. 生铁和钢都属于铁合金,两者抗腐蚀性都很强
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室常用以下几种方法制取氯气。
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式:________________________________________________________________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式:________________________________________________________________________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为________。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。
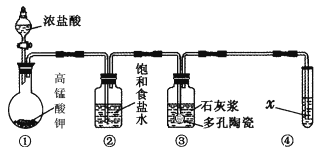
(1) 装置③中发生反应的化学方程式为____________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是________________________________________________________________________。
(2)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为
3ClO-+I-===3Cl-+IO
IO+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯醛结构简式为CH=CH-CHO,下列关有关它的叙述中不正确的是( )
A.能发生银镜反应,表现氧化性
B.能使溴水或酸性KMnO4溶液褪色
C.在一定条件下能被氧气氧化
D.在一定条件下与H2反应生成1一丙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)具有耐高温.抗冲击.导热性好等优良性质,被广泛应用于电子工业.陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:
Al2O3+N2+3C ![]() 2AlN+3CO下列叙述正确的是( )
2AlN+3CO下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
B.氮化铝是铝合金中的一种
C.上述反应中每生成2molAlN,N失去6mol电子
D.氮化铝中氮元素的化合价为﹣3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.CH3COOH和CH3COOCH3互为同系物
B.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
C.石油分馏可以得到丙烯等重要化工原科
D.C6H14的同分异构体有4种,其熔点各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4Br置于密闭容器中,在某温度下,发生下列可逆反应:NH4Br(s) ![]() NH3(g)+HBr(g) 2HBr(g)
NH3(g)+HBr(g) 2HBr(g) ![]() Br2(g)+H2(g),2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用
Br2(g)+H2(g),2min后,测得c(H2)=0.5mol/L,c(HBr)=4mol/L,若上述反应速率用![]() (NH3)表示,下列反应速率正确的是
(NH3)表示,下列反应速率正确的是
A.0.5mol/(L·min) B.2.5 mol/(L·min)
C.2 mol/(L·min) D.5 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“建设大美运城”要求人们出行和化工生产做到“绿色、低碳”。下列做法不可取的是
A.推广共享公共工具B.大力开发化石能源
C.推广使用新型能源D.推广使用电子货币
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如下图所示。下列说法不正确的是

A. 每消耗3mol H2O2,转移6mol e-
B. 电池工作时Na+从b极区移向a极区
C. b极上的电极反应式为:H2O2 + 2e-= 2OH-
D. a极上的电极反应式为:BH4-+ 8OH--8e-=BO2-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NH3、N2H4在工业生产和国防建设中都有广泛应用。
①N2H4(g)![]() N2(g)+2H2(g) △H1=akJ·mol-1
N2(g)+2H2(g) △H1=akJ·mol-1
②N2(g)+3H2(g)![]() 2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
③7N2H4(g)![]() 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3
则△H3=_________(用含a和b的代数式表示)
(2)N2中存在_________键(填“极性”或“非极性”),NH3的VSEPR模型是______________。用短线表示共价键,小黑点表示孤对电子的结构式叫路易斯结构式,NH4的路易斯结构式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com