
【题目】H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂。有研究表明,H2O2溶液的漂白性是HO2—所致。
(1) H2O2溶液显弱酸性,测得0.15 mol·L1 H2O2溶液pH约为6。写出H2O2生成HO2—的电离方程式: 。
(2)其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下:
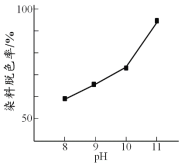
由上图可得到的结论是 ,结合平衡移动原理简述理由: 。
(3)实验发现: 若pH >11,则H2O2溶液的漂白效果随pH增大而降低。针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关。测定不同初始pH条件下,初始浓度均为0.15 mol·L1 的H2O2溶液发生分解反应,结果如下:
初始pH | pH = 10 | pH = 12 |
1小时后H2O2溶液浓度 | 0.13 mol·L1 | 0.07 mol·L1 |
1小时后pH | 没有明显变化 | 没有明显变化 |
查阅资料:HO2—+H2O2=H2O+O2+OH—。
①结合离子方程式解释1小时后pH没有明显变化的原因: 。
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因: 。
【答案】
(1)H2O2![]() HO2-+ H+
HO2-+ H+
(2)结论:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;
原因:c(OH-)增大,促使H2O2![]() HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好
HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好
(3)① 碱性条件下:H2O2 + OH-= HO2-+ H2O,又知HO2-+ H2O2 = H2O + O2 + OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变② pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低;
【解析】
试题分析:(1)H2O2生成HO2—的电离方程式为H2O2![]() HO2-+ H+,故答案为:H2O2
HO2-+ H+,故答案为:H2O2![]() HO2-+ H+;
HO2-+ H+;
(2)根据图像可知,其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;因为c(OH-)增大,促使H2O2![]() HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好,故答案为:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;c(OH-)增大,促使H2O2
HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好,故答案为:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;c(OH-)增大,促使H2O2![]() HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好;
HO2-+ H+正向移动,c(HO2-)增大,漂白效果越好;
(3)①碱性条件下:H2O2 + OH-= HO2-+ H2O,又知HO2-+ H2O2 = H2O + O2 + OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变,故答案为:碱性条件下:H2O2 + OH-= HO2-+ H2O,又知HO2-+ H2O2 = H2O + O2 + OH-,OH-可看作是H2O2分解反应的催化剂,故反应前后pH不变;②pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低,故答案为:pH过大,H2O2分解过快,使参与漂白的c(HO2-)下降,故漂白效果降低。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:
【题目】安徽古代科学家方以智在其《物理小识》卷七《金石类》中指出:有硇水者,剪银块投之,则旋而为水。其中的“硇水”指 ( )
A. 硝酸 B. 硫酸 C. 盐酸 D. 醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氢氧化铜存在平衡:Cu(OH)2 + 2OH—![]() Cu(OH)42—(深蓝色)。某同学进行下列实验:
Cu(OH)42—(深蓝色)。某同学进行下列实验:
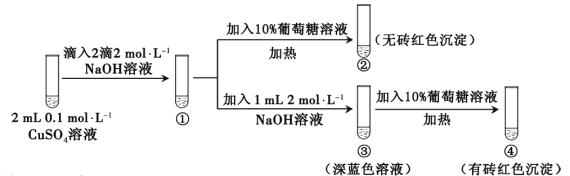
下列说法不正确的是
A. ①中出现蓝色沉淀
B. ③中现象是Cu(OH)2 + 2OH—![]() Cu(OH)42—正向移动的结果
Cu(OH)42—正向移动的结果
C. ④中现象证明葡萄糖具有还原性
D. 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为
A. 1:1 B. 5:1 C. 1:5 D. 3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是一种简单易行、行之有效的科学方法,人们在认识事物时可以采取多种分类方法。下列关于“H2CO3”的分类不正确的是(
A.二元酸 B.强电解质 C.含氧酸 D.弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的说法错误的是
A. 热稳定性:HCl> HI B. 原子半径:Na> Mg
C. 酸性:H2SO3>H2SO4。 D. 结合质子能力:S2-> Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25mL 0.1 mol·L-1 MOH 溶液中逐滴加入0.2 mol·L-1 HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
(1)MOH与HA恰好完全反应时,溶液呈 性(填“酸”、“碱”或“中”),用离子方程式表示其原因 。
此时,混合溶液中由水电离出的c(H+) 0.2mol.L-1 HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(2)D点时,溶液中c(A-)+c(HA) 2c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则c(HA)+c(H+)= mol·L-1(数字表达式,不必具体算出结果)。
(3)分别写出C点混合溶液中各离子浓度的大小关系 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是
A.NH4H的电子式为![]()
B.NH4Cl的电子式为![]()
C.NH4H含有极性共价键和离子键
D.NH4H固体投入少量热水中,有两种气体生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com