
【题目】分类法是一种简单易行、行之有效的科学方法,人们在认识事物时可以采取多种分类方法。下列关于“H2CO3”的分类不正确的是(
A.二元酸 B.强电解质 C.含氧酸 D.弱酸
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
【题目】聚乙炔能够导电,下列关于聚乙炔![]() 和聚合物A
和聚合物A![]() 的说法中正确的是
的说法中正确的是
A.两种聚合物的单体互为同系物
B.聚合物A不属于单双键交错的结构
C.聚合物A的相对分子质量是聚乙炔的两倍
D.1 mol两种聚合物的单体分别与Br2发生加成反应,最多消耗Br2的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种化合物均由1~18号元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。请回答:

(1)W的分子式是___________。
(2)X与Y在溶液中反应的离子方程式是__________________。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置快速制取少量的O2,并演示Na在O2中的燃烧实验。

①关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气______ (填“漏气”、“不漏气”或“无法确定”) ,判断理由是______。
②写出A装置中反应的化学方程式并标出电子得失情况:__________。
③C装置中观察到的现象是___________。
④D装置中盛放的试剂是__________,其作用是____________。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中,能大量共存的离子组是
A. Al3+、Ag+、NO3-、Cl- B. Mg2+、NH4+、NO3-、Cl-
C. Ba2+、K+、S2-、Cl- D. Na+、NO3-、HCO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂。有研究表明,H2O2溶液的漂白性是HO2—所致。
(1) H2O2溶液显弱酸性,测得0.15 mol·L1 H2O2溶液pH约为6。写出H2O2生成HO2—的电离方程式: 。
(2)其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下:
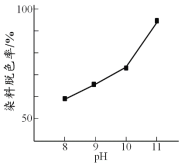
由上图可得到的结论是 ,结合平衡移动原理简述理由: 。
(3)实验发现: 若pH >11,则H2O2溶液的漂白效果随pH增大而降低。针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关。测定不同初始pH条件下,初始浓度均为0.15 mol·L1 的H2O2溶液发生分解反应,结果如下:
初始pH | pH = 10 | pH = 12 |
1小时后H2O2溶液浓度 | 0.13 mol·L1 | 0.07 mol·L1 |
1小时后pH | 没有明显变化 | 没有明显变化 |
查阅资料:HO2—+H2O2=H2O+O2+OH—。
①结合离子方程式解释1小时后pH没有明显变化的原因: 。
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“地沟油”是用饭店的泔水及垃圾猪肉等加工而成的“食用油”。下列有关说法中正确的是( )
A. “地沟油”的主要成分是蛋白质,还含有较多的微量元素
B. “地沟油”外观与普通食用油一样,经过处理的“地沟油”具有固定的熔沸点
C. “地沟油”在加入消泡剂后,消除了其对人体健康的影响
D. “地沟油”可用于生产生物柴油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.食盐水在电流作用下电离成钠离子和氯离子
B.强电解质的水溶液的导电能力一定比弱电解质的水溶液的导电能力强
C.电解质溶液中已电离出的离子和未电离的分子可以共存
D.电解质溶液的导电过程,与金属导体相同,都是物理过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一条件下,把物质A,B按一定比例充入容积为2L的球开容器,发生如下反应:
2A(g)+B(g)![]() 2C(g);△H=-180KJ.mol-1
2C(g);△H=-180KJ.mol-1
(1) 写出该反应的化学平衡常数表达式 K=__________________
(2)降低温度,该反应K值_________,A转化率____________,化学反应速度________(以上均填“增大,减小或不变”)
(3) 若平均每分钟生成0.5mol的C,则此反应速率可表示为V(C)=__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com