
【题目】下表为周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是________(元素符号)。
(2)写出元素溴的基态原子的简化电子排布式_____________________,写出⑩的价电子排布图_____________________________________。
(3)某元素⑦的原子核外最外层电子的成对电子为________对。
(4)元素④的氢化物的分子构型为________,中心原子的杂化形式为________。
(5)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“⑧”为________(填元素符号);其中电负性最大的是________(填元素符号)。

(6)⑩的基态原子有____种能量不同的电子;如图___(填“甲”、“乙”或“丙”)表示的是⑩晶体中微粒的堆积方式。晶体中距离一个⑩原子最近的⑩原子有____个。若该晶体中一个晶胞的边长为a pm,则⑩晶体的密度为__________g.cm-3(写出含a的表达式,用NA表示阿伏加德罗常数的值,不需化简)。若⑩的原子半径为r,则⑩晶胞这种堆积模型的空间利用率为__________。

【答案】Fe[Ar]3d104s24p5![]() 3三角锥形sp3SiCl7乙12
3三角锥形sp3SiCl7乙12![]()
![]()
【解析】
根据周期表的结构可知各元素分别为:①H ②Be ③C ④N ⑤Al ⑥S ⑦Cl ⑧Ca ⑨Fe ⑩Cu;
(1)d区元素包括ⅢB-ⅦB元素,Ⅷ族元素,为第3列到10列元素(镧系元素、锕系元素除外),由元素在周期表中位置可以知道,⑨元素Fe处于第8列,为第Ⅷ族元素,属于d区的元素;因此,本题正确答案是:Fe。
(2) 溴原子的核电荷数为35,其基态原子的简化电子排布式:[Ar]3d104s24p5 ;⑩元素为Cu,核电荷数为29,原子基态电子排布式:[Ar]3d104s1, 其价电子为排布图:![]() ;综上所述,本题答案是:[Ar]3d104s24p5 ,
;综上所述,本题答案是:[Ar]3d104s24p5 , ![]() 。
。
(3)⑦元素为Cl,核电荷数为17,原子核外最外层电子为7,特征电子排布式为3s23p5, s能级为成对电子,p能级5个电子各占据3个轨道,其中一个轨道只有1个电子,所以成对电子为3对;综上所述,本题答案是:3。
(4)④元素为N,氢化物为NH3,N原子价层电子对数=3+(5-1×3)/2=4,含有1对孤对电子,故NH3为三角锥型,N原子产生sp3杂化;综上所述,本题答案是:三角锥形,sp3。
(5)第3周期8种元素中Si是原子晶体,单质的熔点最高;同周期自左而右电负性增强(稀有气体除外),故Cl元素的电负性最强;因此,本题正确答案是:Si 、Cl。
(6)⑩元素为Cu,核电荷数为29,基态核外电子排布为:1s22s22p63s23p63d104s1,因为1s、2s、2p、3s、3p、3d、4s能级能量不同,所以有7种能量不同的电子;Cu为面心立方最密堆积,是面心立方最密堆积型,故为图乙结构;根据铜晶胞可知,铜晶体为面心立方结构,顶点离面心的铜原子距离最近,一个晶胞中,一个顶点的晶胞有8个,共24个面心铜原子,1个面心铜原子由2个晶胞共有,因此晶体中距离一个铜原子最近的铜原子有12个;晶胞中Cu原子数目=8×1/8+6×1/2=4,晶胞质量=4×64/NAg,该晶体中一个晶胞的边长为a pm,则晶胞体积=(a×10-10)3cm3,晶体的密度=(4×64/NA)÷(a×10-10)3=![]() g/cm3;若Cu的原子半径为r,设晶胞边长为a,由图可知,(4r)2=a2+a2,则晶胞棱长a=4r×
g/cm3;若Cu的原子半径为r,设晶胞边长为a,由图可知,(4r)2=a2+a2,则晶胞棱长a=4r×![]() =2
=2![]() r,则晶胞体积=(2
r,则晶胞体积=(2![]() r )3,晶胞中Cu原子总体积=4×4/3πr3,则Cu晶胞这种堆积模型的空间利用率为(4×4/3πr3)/(2
r )3,晶胞中Cu原子总体积=4×4/3πr3,则Cu晶胞这种堆积模型的空间利用率为(4×4/3πr3)/(2![]() r )3=
r )3=![]() ;综上所述,本题答案是:7 ,乙 ,12,
;综上所述,本题答案是:7 ,乙 ,12, ![]() ,
,![]() 。
。


科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
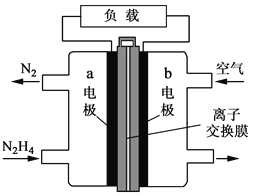
A. b极发生氧化反应
B. a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电流从a极经过负载流向b极
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO![]() 。关于该物质的说法正确的是( )
。关于该物质的说法正确的是( )
A. 该物质属于两性氢氧化物
B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H![]()
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体说法的正确组合是

①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列叙述错误的是( )
A.还原铁粉能用作食品包装袋中的抗氧化剂
B.中国华为自主研发的5G芯片巴龙5000的主要材料是SiO2
C.快餐盒用生物质材料“玉米塑料”(主要成分为可降解聚乳酸)可以减少白色污染
D.制冷压缩机中的氨是制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水芹烯是一种具有祛痰、抗菌、杀虫作用的添加剂,由水芹烯合成聚合物H的路线如图所示。
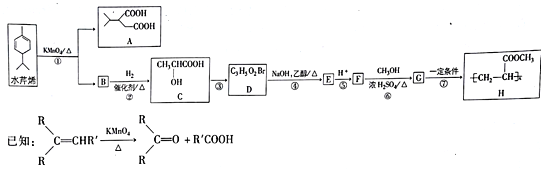
回答下列问题:
(1)水芹烯的分子式为_______ ,C的系统命名为_________________,反应④的反应类型为____。
(2)D分子中的官能团为(写名称)_______________,B的结构简式为___________ 。
(3)反应⑥的化学反应方程式为___________________________________。H在NaOH水溶液中发生水解反应的化学方程式为________________________________________。
(4)M是G的同分异构体,且能与NaHCO3反应生成CO2,则M的可能结构有________种(考虑立体异构)
(5)乙酸异丙酯CH3COOCH(CH3)2是重要的有机化工中间体,写出以2-甲基-2-丁烯为原料(其他无机试剂任选)制备乙酸异丙酯的合成路线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 标准状况下,2.24LCCl4含有的共价键数为0.4NA
B. 常温下,14 g的![]() 含中子数目为6NA
含中子数目为6NA
C. 用铂电极电解100 mL 1 mol L-1的CuSO4溶液足够长时间,转移电子数一定为0.2NA
D. 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:__________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。

(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com