
【题目】2molX2和2molY2正好化合生成4molZ,则Z的化学式为
A.XYB.X3Y2C.X2Y3D.XY3
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取有机物A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。A分子的质谱图如下图所示:
| (1)有机物A的摩尔质量为______。 |
(2)将此9.0g A在足量纯O2充分燃烧,并使 其产物依次通过无水氯化钙、无水硫酸铜、碱石灰。实验后硫酸铜粉末没有变蓝,称量无水氯化钙增重5.4g,碱石灰增重13.2g。 | (2)经计算,有机物A的分子式为_______。 |
(3)经红外光谱测定,证实其中含有-OH和-COOH两种官能团;经核磁共振氢谱的测定,其核磁共振氢谱图如下图:
| (3)A的结构简式____________________。 |
(4)经红外光谱测定,A的一种同分异构体B中,含有与A相同的官能团。 | (4)A的同分异构体B的结构简式为:____。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化亚铁和氯化铁的混合物,现要测定其中FeCl2和FeCl3的物质的量,按以下步骤进行实验:
(1)将混合物配制成250mL的待测溶液,所用到的玻璃仪器除烧杯、胶头滴管、玻璃棒外,还必须有_______(填仪器名称)。
(2)取25.00mL待测溶液,向其中通入标准状况下336mLCl2恰好将Fe2+氧化为Fe3+,请写出通入氯气发生的反应的离子方程式:_______________;由此可知原溶液中n(FeCl2)=___________mol。
(3)向(2)反应后所得到溶液中加入过量的NaOH溶液,然后进行过滤,将所得沉淀洗涤干净,加热、灼烧该沉淀,冷却至室温后,准确称量可知,得到红棕色固体粉末3.2g,由此可以确定原溶液中c(FeCl3)=________mol·L—1 。
(4)检验Fe3+中含有Fe2+ 的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)反应在三种不同的条件下进行,反应物SO2的物质的量(mol)随反应时间(min)的变化情况如下表所示:
2SO3(g)反应在三种不同的条件下进行,反应物SO2的物质的量(mol)随反应时间(min)的变化情况如下表所示:

(1)对照实验1,实验2改变的某一外界条件可能是_______。
(2)反应达平衡后,向实验2中加入少量的18O2,一段时间18O后可能存在于哪些物质中________(填选项)。
A 只存在氧气 B 只存在三氧化硫 C 只存在反应物 D 存在反应物与生成物
(3)实验3中,在5~15min时段,用O2表示的平均反应速率为______ mol/(L·min)。
(4)若将实验1置于绝热体系中,测得实验到达平衡的时间比原来缩短了,则参加反应的SO2和O2的总能量______(填“>”、“<”或“=”)生成的SO3的总能量。
(5)能说明实验3达到平衡状态的标志是_______(任写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型,请回答下列问题:

(1)向丙中加入溴水,振荡静置后,观察到溶液分层,上层为_______色。
(2)甲的同系物的通式为CnH2n+2,当n=5时,写出含有3个甲基的有机物的结构简式_____。
下图是用乙制备D的基本反应过程

(3)A中官能团为__________。
(4)反应①的反应类型是__________。
(5)写出反应④的化学方程式_______。
(6)现有138gA和90gC发生反应得到80gD。试计算该反应的产率为______(用百分数表示,保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在氧气里充分燃烧,生成的CO2和H2O的物质的量之比为1∶1,由此可以得出该有机物( )
A.分子中肯定只含C、H两种元素
B.分子中C和H的个数比为1∶2
C.分子中肯定含有氧原子
D.分子中C、H、O的个数比为1∶2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一):意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的 ΔH=______________

(二):50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________________。
(2)烧杯间填满碎纸条的作用是__________________________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值_________________(填“偏大”、“偏小”或“无影响”)。
(4)实验中60 mL0.50 mol/L盐酸与50 mL0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”或“不相等”),所求中和热_________(填“相等”或“不相等”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是________(元素符号)。
(2)写出元素溴的基态原子的简化电子排布式_____________________,写出⑩的价电子排布图_____________________________________。
(3)某元素⑦的原子核外最外层电子的成对电子为________对。
(4)元素④的氢化物的分子构型为________,中心原子的杂化形式为________。
(5)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“⑧”为________(填元素符号);其中电负性最大的是________(填元素符号)。

(6)⑩的基态原子有____种能量不同的电子;如图___(填“甲”、“乙”或“丙”)表示的是⑩晶体中微粒的堆积方式。晶体中距离一个⑩原子最近的⑩原子有____个。若该晶体中一个晶胞的边长为a pm,则⑩晶体的密度为__________g.cm-3(写出含a的表达式,用NA表示阿伏加德罗常数的值,不需化简)。若⑩的原子半径为r,则⑩晶胞这种堆积模型的空间利用率为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数之和为46,它们在周期表中的相对位置如图所示。下列说法正确的是
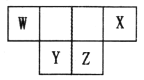
A. 原子半径大小顺序为:Y>Z>X
B. X元素最高价氧化物的水化物酸性最强
C. Y元素的简单氢化物稳定性最强
D. Z单质难溶于化合物WZ2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com