
【题目】(一):意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的 ΔH=______________

(二):50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________________。
(2)烧杯间填满碎纸条的作用是__________________________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值_________________(填“偏大”、“偏小”或“无影响”)。
(4)实验中60 mL0.50 mol/L盐酸与50 mL0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”或“不相等”),所求中和热_________(填“相等”或“不相等”).
【答案】-882KJ/mol 环形玻璃搅拌棒减少实验过程中的热量损失偏小不相等相等
【解析】
(一)根据化学键断裂要吸收热量,形成化学键要放出热量,反应热就是断键吸收的能量和形成化学键所放出的能量的差值。(二)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条和盖硬纸板的作用是减少实验过程中的热量损失;中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关。
(一)1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为:6×167kJ=1002kJ,形成化学键放出的热量为1884kJ,所以反应放热,放出的热量为:1884kJ-1002kJ=882kJ,故应为放出882kJ热量。(二)(1)在反应热的测定实验中需要进行搅拌,保证反应的两种溶液可以迅速反应,缩短反应的时间,减小误差,所以装置中缺少的玻璃用品是环形玻璃搅拌棒;(2)实验过程中应该尽可能的减小热量的损失,所以装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失;(3)大烧杯上如不盖硬纸板,则会造成热量的损失,则求得的中和热数值将偏小;(4)改用60 mL 0.50mol/L盐酸跟50 mL 0.55mol/LNaOH溶液进行反应氢氧化钠反应完全生成的水为0.0275mol,原反应盐酸反应完全生成的水为0.025mol,反应生成水的量不同,所以放出的热量也不相等,但是所求的中和热相等,因为中和热指酸碱发生中和反应生成1mol水时所放出的热量,与酸和碱的用量没有关系。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】有机化合物“利尿酸”是一种常见的兴奋剂,其分子结构如下图,下列说法正确的是

A. 利尿酸是芳香烃
B. 利尿酸与AgNO3溶液反应有白色沉淀生成
C. 一定条件下,利尿酸能发生取代反应、加成反应和酯化反应
D. 1mol利尿酸与饱和碳酸钠溶液反应能放出1 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是重要的化工原料,工业上可用丙烯加成法生产,主要副产物为3-氯丙烯(CH2=CHCH2C1) ,反应原理为
i.CH2=CHCH,3(g)+Cl2(g)![]() CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
CH2ClCHClCH3(g) ΔH1= -134 kJ mol-1
ii.CH2=CHCH,3(g)+Cl2(g)![]() CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
CH2=CHCH2Cl (g)+HCl(g) ΔH2= -l02 kJ mol-1
已知:相关化学键的键能数据如下表所示:
化学键 | C=C | C—C | C—Cl | Cl—Cl |
E/( kJ mol-1) | 611 | x | 328 | 243 |
请回答下列问题:
(1)由反应i计算出表中x=_____________。
(2)一定温度下,密闭容器中发生反应i和反应ii,达到平衡后增大压强,CH2C1CHC1CH3的产率______(填“增大”“减小”或“不变”),理由是_________________________________。
(3)T1℃时,向10L恒容的密闭容器中充入1 mol CH2=CHCH2C1和2 mol HC1,只发生反应CH2=CH CH2Cl (g)+HCl(g)![]() CH2ClCHClCH3(g) ΔH3。 5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
CH2ClCHClCH3(g) ΔH3。 5min反应达到平衡,测得 05 min内,用CH2ClCHClCH3表示的反应速率 v(CH2ClCHClCH3)=0.016 mol·L-1 min-1。
①平衡时,HCl的体积分数为_________(保留三位有效数字)。
②保持其它条件不变,6 min时再向该容器中充入0.6 mol CH2=CHCH2Cl、0.2molHC1和0.1mol CH2ClCHClCH3,则起始反应速率 v正(HCl)___ V逆(HCl) (填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO![]() 。关于该物质的说法正确的是( )
。关于该物质的说法正确的是( )
A. 该物质属于两性氢氧化物
B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H![]()
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体说法的正确组合是

①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水芹烯是一种具有祛痰、抗菌、杀虫作用的添加剂,由水芹烯合成聚合物H的路线如图所示。
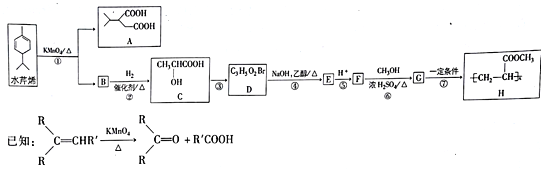
回答下列问题:
(1)水芹烯的分子式为_______ ,C的系统命名为_________________,反应④的反应类型为____。
(2)D分子中的官能团为(写名称)_______________,B的结构简式为___________ 。
(3)反应⑥的化学反应方程式为___________________________________。H在NaOH水溶液中发生水解反应的化学方程式为________________________________________。
(4)M是G的同分异构体,且能与NaHCO3反应生成CO2,则M的可能结构有________种(考虑立体异构)
(5)乙酸异丙酯CH3COOCH(CH3)2是重要的有机化工中间体,写出以2-甲基-2-丁烯为原料(其他无机试剂任选)制备乙酸异丙酯的合成路线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。
在一恒容密闭容器中分别投入1 molCO2、3molH2,发生反应:2CO2(g)+ 6H2(g)![]() C2H4(g) +4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图。则△H______ 0 (填“>”“<”或“不能确定”)。
C2H4(g) +4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图。则△H______ 0 (填“>”“<”或“不能确定”)。

Ⅱ. 甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。

(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右上图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(3)甲醇是重要的化工原料,可作为燃料。对于上述反应①而言:
(I)若该反应在恒温恒容条件下进行,下列说法正确的是_________;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(II)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数 K=50,反应到某时刻测得各组分的物质的量如下:
物质 | CO | H2 | CH3OH |
物质的量/mol | 0.4 | 0.4 | 0.8 |
请比较此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com