
【题目】某氯化亚铁和氯化铁的混合物,现要测定其中FeCl2和FeCl3的物质的量,按以下步骤进行实验:
(1)将混合物配制成250mL的待测溶液,所用到的玻璃仪器除烧杯、胶头滴管、玻璃棒外,还必须有_______(填仪器名称)。
(2)取25.00mL待测溶液,向其中通入标准状况下336mLCl2恰好将Fe2+氧化为Fe3+,请写出通入氯气发生的反应的离子方程式:_______________;由此可知原溶液中n(FeCl2)=___________mol。
(3)向(2)反应后所得到溶液中加入过量的NaOH溶液,然后进行过滤,将所得沉淀洗涤干净,加热、灼烧该沉淀,冷却至室温后,准确称量可知,得到红棕色固体粉末3.2g,由此可以确定原溶液中c(FeCl3)=________mol·L—1 。
(4)检验Fe3+中含有Fe2+ 的方法是____________。
【答案】250mL容量瓶 2Fe2++Cl2=2Fe3++2Cl— 0.3 0.4 滴加酸性KmnO4溶液,若溶液褪色,则证明Fe3+中含有Fe2+
【解析】
(1)依据配制250mL的待测溶液,所需的玻璃仪器分析缺少的仪器;
(2)将Cl2通入FeCl2溶液中,生成FeCl3,依据反应的化学方程式计算25ml溶液中FeCl2的物质的量;
(3) 向(2)反应后所得到溶液中加入过量的NaOH溶液,生成Fe(OH)3沉淀,Fe(OH)3受热分解生成Fe2O3,得到红棕色固体粉末3.2g的Fe2O3,其中的Fe是原溶液中的FeCl2、FeCl3中的铁的总和,由此计算原溶液中的c(FeCl3);
(4)因Fe2+具有 还原性可是酸性高锰酸钾溶液褪色,以此选择检验Fe2+的试剂和方法。
(1)配制250mL的待测溶液,需要的玻璃仪器除烧杯、胶头滴管、玻璃棒外,还必须有250ml的容量瓶;
本题答案为:250ml的容量瓶。
(2)将Cl2通入FeCl2溶液中,生成FeCl3,离子方程式为:2Fe2+![]() Cl2=2Fe3+
Cl2=2Fe3+![]() -,依据反应的离子方程式,336mLCl2的物质的量为:n(Cl2)=
-,依据反应的离子方程式,336mLCl2的物质的量为:n(Cl2)=![]() =0.015mol,设336mLCl2可氧化Fe2+的物质的量为x,则有1:2=0.015:x,则x=0.03mol,原溶液中含n(Fe2+)=0.03mol
=0.015mol,设336mLCl2可氧化Fe2+的物质的量为x,则有1:2=0.015:x,则x=0.03mol,原溶液中含n(Fe2+)=0.03mol![]() 10=0.3mol,n(FeCl2)= n(Fe2+)=0.3mol;
10=0.3mol,n(FeCl2)= n(Fe2+)=0.3mol;
本题答案为:2Fe2+![]() Cl2=2Fe3+
Cl2=2Fe3+![]() 2Cl-,0.3。
2Cl-,0.3。
(3)向(2)反应后所得到溶液中加入过量的NaOH溶液,生成Fe(OH)3沉淀,Fe(OH)3受热分解生成Fe2O3,依据题意25ml溶液中n(Fe)=2n(Fe2O3)=2![]() =0.04mol,由于原溶液含n(Fe2+)=0.03mol,所以含n(Fe3+)=0.04mol-0.03mol=0.01mol因为n(FeCl3)= n(Fe3+),所以25ml溶液中含n(FeCl3)=0.01mol,故250ml溶液中含三氯化铁的物质的量为:n(FeCl3)=0.1mol,其浓度为:c(FeCl3)=
=0.04mol,由于原溶液含n(Fe2+)=0.03mol,所以含n(Fe3+)=0.04mol-0.03mol=0.01mol因为n(FeCl3)= n(Fe3+),所以25ml溶液中含n(FeCl3)=0.01mol,故250ml溶液中含三氯化铁的物质的量为:n(FeCl3)=0.1mol,其浓度为:c(FeCl3)=![]() =0.4mol/L,
=0.4mol/L,
本题答案为:0.4。
(4)因Fe2+具有还原性,可使酸性高锰酸钾溶液褪色,故滴加酸性KmnO4溶液,若溶液褪色,则证明Fe3+中含有Fe2+;
本题答案为:滴加酸性KmnO4溶液,若溶液褪色,则证明Fe3+中含有Fe2+。


科目:高中化学 来源: 题型:
【题目】当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇(可逆反应),这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式______________________________________________。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。
a.体系压强不再改变
b.H2的浓度不再改变
c.气体的密度不随时间改变
d.单位时间内消耗H2和CO2的物质的量之比为3:1
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图。

根据图中数据
①降低温度,平衡向________方向移动。
②在700 K、起始投料比![]() =1.5时,H2的转化率为________。
=1.5时,H2的转化率为________。
③在500 K、起始投料比![]() =2时,达到平衡后H2的浓度为a mol·L-1,则达到平衡时CH3CH2OH的浓度为________。
=2时,达到平衡后H2的浓度为a mol·L-1,则达到平衡时CH3CH2OH的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
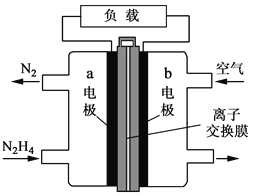
A. b极发生氧化反应
B. a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电流从a极经过负载流向b极
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整_________。
(2)实验中他们取6.4 g铜片和12 mL 18 mol·L1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:__________________;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是__________________;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是________(填编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)装置C中试管D内盛装的是品红溶液,当B中气体收集满后,有可能观察到的现象是_____________,待反应结束后,向C中烧杯内加入沸水,D中观察到的现象是_____________。
(4)实验装置C有可能造成环境污染,试用最简单的方法加以解决,__________________(实验用品自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物“利尿酸”是一种常见的兴奋剂,其分子结构如下图,下列说法正确的是

A. 利尿酸是芳香烃
B. 利尿酸与AgNO3溶液反应有白色沉淀生成
C. 一定条件下,利尿酸能发生取代反应、加成反应和酯化反应
D. 1mol利尿酸与饱和碳酸钠溶液反应能放出1 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水芹烯是一种具有祛痰、抗菌、杀虫作用的添加剂,由水芹烯合成聚合物H的路线如图所示。
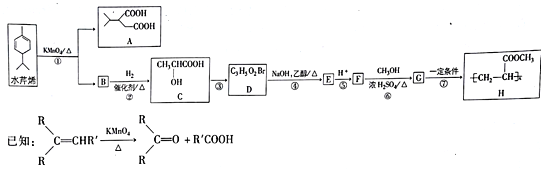
回答下列问题:
(1)水芹烯的分子式为_______ ,C的系统命名为_________________,反应④的反应类型为____。
(2)D分子中的官能团为(写名称)_______________,B的结构简式为___________ 。
(3)反应⑥的化学反应方程式为___________________________________。H在NaOH水溶液中发生水解反应的化学方程式为________________________________________。
(4)M是G的同分异构体,且能与NaHCO3反应生成CO2,则M的可能结构有________种(考虑立体异构)
(5)乙酸异丙酯CH3COOCH(CH3)2是重要的有机化工中间体,写出以2-甲基-2-丁烯为原料(其他无机试剂任选)制备乙酸异丙酯的合成路线_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com