
若溶液中由水电离产生的c(OH-)=1×10-14 mol∙L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO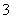 、Cl- B.K+、Na+、Cl-、NO
、Cl- B.K+、Na+、Cl-、NO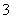
C.K+、Na+、Cl-、AlO D.K+、NH
D.K+、NH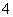 、SO
、SO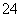 、NO
、NO
科目:高中化学 来源: 题型:
现有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4 Cl。
(1)只由离子键构成的物质是__________ (填序号,下同)
(2)只由共价键构成的物质是__________
(3)只由非金属元素组成的离子化合物是__________
(4)由离子键和共价键构成的物质是__________
(5)写出⑤H2O2的电子式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列热化学方程式分析,C(s)的燃烧热△H等于 ( )
C(s) + H2O(l) === CO(g) + H2(g); △H1 ==175.3kJ·mol—1
2CO(g) + O2(g) == 2CO2(g); △H2 == —566.0 kJ·mol—1
2H2(g) + O2(g) == 2H2O(l); △H3 == —571.6 kJ·mol—1
A. △H1 + △H2 —△H3 B.2△H1 + △H2 + △H3
C. △H1 + △H2/2 + △H3 D. △H1 + △H2/2 + △H3/2
查看答案和解析>>
科目:高中化学 来源: 题型:
把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸发生反应,其中反应速率最快的是( )
A.10℃ 20 mL 3 mol·L-1的X溶液
B.20℃ 30 mL 2 mol·L-1的X溶液
C.20℃ 10 mL4 mol·L-1的X溶液
D.10℃ 10 mL 2 mol·L-1的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
不能说明醋酸是弱电解质的事实是( )
A.醋酸溶液的导电性比盐酸弱
B.向醋酸钠溶液中通入少量氯化氢,c(CH3COO-)减小
C.0.1 mol/L的醋酸溶液的pH约为3
D.pH=1的醋酸溶液用水稀释1000倍后,pH<4
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是( )
A.Q1=2Q2=92.4 B.Ql>2Q2 C.Q1<2Q2 D.Q1=2Q2≠92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用重铬酸钠(Na2Cr2O7)给晶后的母液(含少量杂质Fe3+生产重铬酸钾(K2Cr2O7)。工艺流程及相关物质溶解度曲线如图所示:
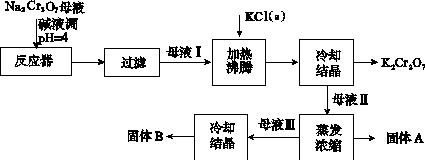
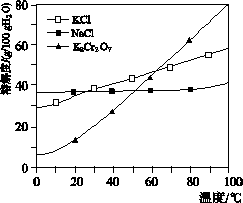
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为____________________________________________。通过冷却结晶析出大量K2Cr2O2的原因是__________________________________________________________。
(2)向Na2Cr2O7母液中加碱液调pH的目的是________________________________________。
(3)固体A主要为________(填化学式)。固体B主要为________(填化学式)。
(4)用热水洗涤固体A,回收的洗涤液转移到母液______(填“Ⅰ”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗最低。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)氯碱工业是利用电解食盐水生产________为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO 等杂质离子,下列加入顺序合理的是________。
等杂质离子,下列加入顺序合理的是________。
A.碳酸钠、氢氧化钠、氯化钡
B.碳酸钠、氯化钡、氢氧化钠
C.氢氧化钠、碳酸钠、氯化钡
D.氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于 酸的物质 |
| 质量分数/% | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
为了生产七水硫酸镁,设计了以下工艺流程:
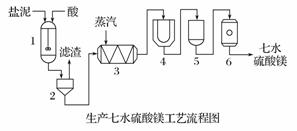
1-反应器 2-过滤器 3-蒸发浓缩器
4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用________,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是________。
装置2中滤渣的主要成分为________。
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是________。
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com