
【题目】某强酸性溶液X中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种,现取X溶液进行实验,实验过程及产物如图。下列说法正确的是
中的若干种,现取X溶液进行实验,实验过程及产物如图。下列说法正确的是![]()
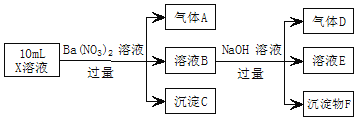
A.A是一种无色、无毒的气体
B.沉淀F为![]()
C.实验室可用排水法收集气体D
D.往溶液E中通入少量![]() ,有沉淀产生
,有沉淀产生
【答案】D
【解析】
强酸性溶液含大量的氢离子,一定不会存在![]() ,结合实验流程可知,加入过量硝酸钡生成沉淀,则该沉淀C为
,结合实验流程可知,加入过量硝酸钡生成沉淀,则该沉淀C为![]() ,说明溶液中含有
,说明溶液中含有![]() 离子,生成气体A,因
离子,生成气体A,因![]() 、硝酸根离子、氢离子发生氧化还原反应,则A为NO,说明溶液中含有还原性离子,一定含
、硝酸根离子、氢离子发生氧化还原反应,则A为NO,说明溶液中含有还原性离子,一定含![]() 离子;溶液B中加入过量NaOH溶液,生成气体D,则D为
离子;溶液B中加入过量NaOH溶液,生成气体D,则D为![]() ,说明溶液中含有
,说明溶液中含有![]() 离子,沉淀物F为
离子,沉淀物F为![]() ,溶液E中含Na+、OH-、NO3-、Ba2+,还可能含AlO2-。
,溶液E中含Na+、OH-、NO3-、Ba2+,还可能含AlO2-。
由上述分析可知,X中一定含![]() 、
、![]() 、
、![]() ,可能含
,可能含![]() 、
、![]() ,一定不含
,一定不含![]() 。
。
A.A为NO,为无色有毒气体,选项A错误;
B.由![]() ,B中含氧化还原反应生成的铁离子,与NaOH反应生成F为
,B中含氧化还原反应生成的铁离子,与NaOH反应生成F为![]() ,选项B错误;
,选项B错误;
C.D为氨气,极易溶于水,不能用排水法收集,选项C错误;
D.溶液E中含Na+、OH-、NO3-、Ba2+,还可能含AlO2-,通入少量二氧化碳可发生Ba2++2OH-+CO2=BaCO3↓+H2O、![]() ,则往溶液E中通入少量
,则往溶液E中通入少量![]() ,有沉淀产生,选项D正确。
,有沉淀产生,选项D正确。
答案选D。


 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾纯品为暗紫色有光泽粉末。在198 ![]() 以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为
以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为K2FeO4,工业制备高铁酸钾的离子方程式为![]() (未配平),下列有关说法不正确的是( )
(未配平),下列有关说法不正确的是( )
A.由上述反应可知,Fe(OH)3的氧化性强于![]()
B.高铁酸钾中铁显 + 6价
C.上述反应氧化剂和还原剂的物质的量之比为3 : 2
D.K2FeO4处理水时,不仅能消毒杀菌,而且生成Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 都是锂离子电池的电极材料,可利用钛铁矿
都是锂离子电池的电极材料,可利用钛铁矿![]() 主要成分为
主要成分为![]() ,还含有少量MgO、
,还含有少量MgO、![]() 等杂质
等杂质![]() 来制备,工艺流程如下:
来制备,工艺流程如下:
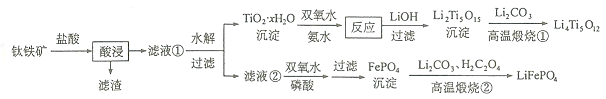
回答下列问题:
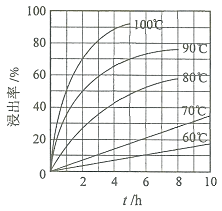
![]() “酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为
“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为![]() 时,所采用的实验条件为______。
时,所采用的实验条件为______。
![]() “酸浸”后,钛主要以
“酸浸”后,钛主要以![]() 形式存在,写出相应反应的离子方程式______。
形式存在,写出相应反应的离子方程式______。
![]() 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度 | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | span>88 |
分析![]() 时
时![]() 转化率最高的原因______。
转化率最高的原因______。
![]() 中Ti的化合价为
中Ti的化合价为![]() ,其中过氧键的数目为______。
,其中过氧键的数目为______。
![]() 若“滤液
若“滤液![]() ”中
”中![]() ,加入双氧水和磷酸
,加入双氧水和磷酸![]() 设溶液体积增加1倍
设溶液体积增加1倍![]() ,使
,使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此时是否有
,此时是否有![]() 沉淀生成?______
沉淀生成?______![]() 列式计算
列式计算![]() 。
。![]() 、
、![]() 的
的![]() 分别为
分别为![]() 、
、![]()
![]() 写出“高温煅烧
写出“高温煅烧![]() ”中由
”中由![]() 制备
制备![]() 的化学方程式______。
的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 某地区的雾霾中可能含有如下可溶性离子:
某地区的雾霾中可能含有如下可溶性离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成如下实验:
某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成如下实验:
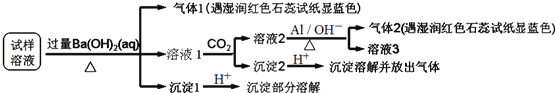
根据以上的实验操作与现象,该同学得出的结论错误的是![]()
A.试样中肯定存在![]() 、
、![]() 和
和![]() ,可能有
,可能有![]()
B.试样中不一定存在![]() 、
、![]() 、
、![]()
C.沉淀2中可能含碳酸钡、碳酸镁和氢氧化铝
D.该雾霾中可能存在![]() 、
、![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A、量取20.0ml待测盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
B、用标准溶液润洗滴定管2-3次;
C、取盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D、取标准NaOH溶液注入碱式滴定管至刻度线0以上2cm-3cm;
E、调节液面至“0”或“0”以下刻度并记下读数;
F、把锥形瓶放在滴定管的下面,用NaOH溶液滴定至终点并记下滴定管液面的刻度
据此实验完成填空:
(1)正确操作步骤的顺序是___。(用序号字母填写)
(2)用标准的NaOH溶液滴定待测盐酸时,左手握碱式滴定管的带有玻璃球的橡胶管部分,右手摇动锥形瓶,眼睛注视___。判断滴定终点的方法是___。
(3)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测液 体积(mL) | 标准NaOH溶液体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
1 | 20.00 | 1.02 | 21.03 |
2 | 20.00 | 2.00 | 21.99 |
3 | 20.00 | 1.20 | 23.20 |
①根据上述数据,可计算出该盐酸的浓度为___(保留两位有效数字).
②在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___(填字母序号)
A.滴定终点读数时俯视读数
B.碱式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5:M=190 g·mol-1)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。焦亚硫酸钠(Na2S2O5)在实验室可用如图装置制备。
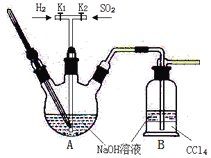
已知:2NaHSO3![]() Na2S2O5+H2O S2O52-+2H+=2SO2↑+H2O
Na2S2O5+H2O S2O52-+2H+=2SO2↑+H2O
(1)实验中如果SO2通入过多,会降低Na2S2O5的产率,试解释其原因__________。
(2)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法(杂质不与碘反应)。
已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+; 2S2O32-+I2 =S4O62-+2I-
称取0.2000 g产品放入碘量瓶中,加入40.00 mL 0.1000 mol·L-1的标准碘溶液,在暗处放置5 min,再加入适量冰醋酸及蒸馏水。用0.2000 mol·L-1的标准Na2S2O3溶液滴定剩余的碘至终点,重复操作3次,测得平均消耗标准Na2S2O3溶液20.00 mL。则产品中焦亚硫酸钠的质量分数为__________________。
(3)关于本实验的说法错误的是_________。
A.B装置中CCl4的作用是防止倒吸
B.滴定时,Na2S2O3溶液应该用碱式滴定管盛放
C.滴定终点的现象是刚好变蓝色
D.滴定时间过长会导致测得产品中焦亚硫酸钠的质量分数偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
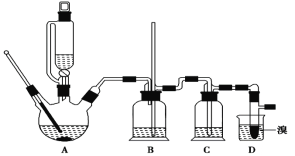
【题目】实验室制备 1,2二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2―→BrCH2CH2Br
CH2=CH2+H2O CH2=CH2+Br2―→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量溴和足量的乙醇 制备1,2-二溴乙烷的装置如下图所示:
有关数据列表如下:
乙醇 | 1 ,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0 .79 | 2.2 | 0 .71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_________。(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置 C 中应加入________,其目的是吸收反应中可能生成的酸性气体。(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断 1,2-二溴乙烷制备反应已经结束的最简单方法是_________________________。
(4)将 1,2 二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__________________层(填“上”、“下”)。
(5)若产物中有少量未反应的 Br2,最好用___________洗涤除去。(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用_____的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应NO2(g)+CO(g)![]() CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是( )
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是( )
A.1/9B.1/6C.2/9D.1/3
查看答案和解析>>
科目:高中化学 来源: 题型:
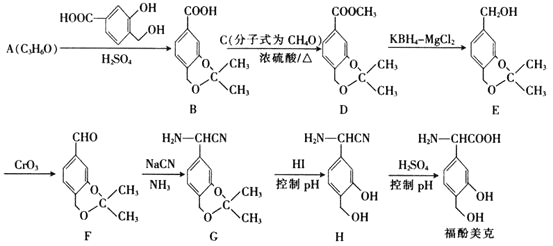
【题目】福酚美克是一种影响机体免疫功能的药物,可通过以下方法合成:
已知:
①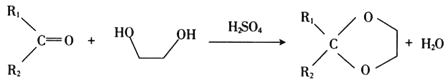 ;
;
②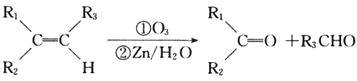 。
。
(1)C的名称为________,A的结构简式为________________。
(2)福酚美克中所含官能团有________________![]() 填名称
填名称![]() 。
。![]() 的反应类型为________。
的反应类型为________。
(3)已知![]() 的转化属于取代反应,则该反应的另一产物的结构简式为________。
的转化属于取代反应,则该反应的另一产物的结构简式为________。
(4)写出F发生银镜反应的化学方程式:________________________________。
(5)E的一种同分异构体Q满足下列条件,则Q的结构简式为________。
①Q的苯环上只有2个取代基,且Q的核磁共振氢谱图中有4组吸收峰
②Q能与![]() 溶液发生显色反应
溶液发生显色反应
③![]() 最多能与
最多能与![]() 发生反应
发生反应
(6)根据已有知识并结合题给信息,写出以![]() 为原料
为原料![]() 无机试剂任用
无机试剂任用![]() 制备
制备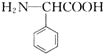 的合成路线流程图_________
的合成路线流程图_________![]() 无机试剂任选
无机试剂任选![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com