
(14分)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g) ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
a、写出由磷酸钙矿制取白磷总的反应方程式_____________________________。
b、上述反应中SiO2起何作用?______________________________________。
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间 (已知磷酸的各级电离常数为:K1 = 7.1×103 K2 = 6.3×108 K3 =4.2×1013 lg7.1≈0.9 lg6.3≈0.8 lg≈0.6) 。Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
⑴a、2Ca3(PO4)2+6SiO2+10C 6CaSiO3+P4+10CO (2分)b、生成CaSiO3放出一定的能量使反应热△H降低;CaSiO3的熔点比SiO2低,成为熔融态浮在表面,对白磷有保护作用 (2分)
6CaSiO3+P4+10CO (2分)b、生成CaSiO3放出一定的能量使反应热△H降低;CaSiO3的熔点比SiO2低,成为熔融态浮在表面,对白磷有保护作用 (2分)
⑵PH3(2分)⑶2.1~7.2 (4分) 3Ca2++2HPO4-=Ca3(PO4 )2↓+2H+(2分) ⑷3mol(2分)
【解析】
试题分析:(1)a、白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到:①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1,②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1,③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1,这说明反应中还有硅酸钙和CO生成,因此由磷酸钙矿制取白磷总的反应方程式为2Ca3(PO4)2+6SiO2+10C 6CaSiO3+P4+10CO。
6CaSiO3+P4+10CO。
b、由于白磷易被氧化,生成CaSiO3放出一定的能量,而CaSiO3的熔点比SiO2低,是硅酸钙成为熔融态浮在表面,对白磷有保护作用 。
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体,则根据氧化还原反应电子得失守恒可知,该气体中P元素的化合价要低于0价,因此该气体是PH3。
(3)如果磷酸只发生一级电离,则根据电离常数可知溶液的pH=3—0.9=2.1。根据二级电离常数可知溶液的pH=8—0.8=7.2,所以工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在2.1~7.2 之间。Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,则发生反应3Ca2++2HPO4-=Ca3(PO4 )2↓+2H+,因此溶液则显酸性。
(4)根据方程式可知被氧化的P化合价从0价升高到+5价,失去5个电子,即1mol白磷失去20mol电子。硫酸铜中铜元素的化合价从+2价降低到+1价,得到1个电子。因此根据电子得失守恒可知60molCuSO4能氧化白磷的物质的量是60mol÷20=3mol。
考点:考查白磷制备、性质、氧化还原反应、离子反应以及电离常数应用等
考点分析: 考点1:氧化还原反应 考点2:化学反应与能量 考点3:弱电解质的电离 考点4:水的电离和溶液的酸碱性 试题属性

 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:2014-2015学年山东省泰安市高三下学期一模理科综合化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42-、NH4+能大量共存
B.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存
C.一定温度下。l L 0.5 mol·L-1NH4C1溶液与2 L 0.25 mol·L-1NH4Cl溶液含NH4+物质的量相同
D.反应ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)说明Ksp(ZnS)>Ksp(CuS)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省江门市高三3月模拟考试理科综合化学试卷(解析版) 题型:选择题
有机物在生活中的应用非常广泛。下列有关说法正确的是
A.食用植物油均可水解生成氨基酸
B.铺路用的沥青主要含有C、H、O等元素
C.做衣服的棉、麻的主要成分是纤维素
D.煤经过汽化、液化等物理变化可转化为清洁燃料
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三3月联考化学试卷(解析版) 题型:实验题
(16分)某研究性学习小组将一定浓度的Na2CO3溶液滴入MgSO4溶液中得到白色沉淀。甲同学认为两者反应只生成MgCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Mg(OH)2一种沉淀;丙同学认为生成MgCO3和Mg(OH)2两种沉淀。(查阅资料知:MgCO3和Mg(OH)2均不带结晶水)
(1)按照乙同学的理解Na2CO3溶液和MgSO4溶液反应的化学反应方程式为__ _____;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤②洗涤③干燥。
(2)请用下图所示装置,选择合适的实验装置和必要的试剂,证明沉淀物中只有碳酸镁。

各装置连接顺序为__________________(用装置编号表示);
②装置C中装有试剂的名称是______________;
③能证明生成物中只有MgCO3的实验现象是 _______。
(3)若Mg(OH)2和MgCO3两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。

实验结束时通入过量的空气的作用________________ 。
A装置和E装置的共同作用是__________________________。
实验过程中测定的数据有:W1:样品的质量,W2:反应后装置B中残渣的质量,W3:反应生成水的质量,W4:反应生成二氧化碳的质量,为了测定其组成,至少需要其中 个数据,请将可能的组合填入下表中(每个空格中填一种组合,至少填5个)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三3月联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移
B.含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022
C.28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子
D.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长望浏宁四县高三一模考试化学试卷(解析版) 题型:选择题
乙酸橙花酯是一种食用香料,其结构简式如右图所示,关于该有机物的下列叙述中正确的是
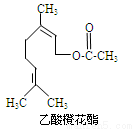
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属
于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A.①②③ B.①②⑤ C.①②⑤⑥ D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省七市教科研协作体高三3月联考化学试卷(解析版) 题型:实验题
二氧化氯(ClO2)为一种黄绿色气体,是一种高效、广谱、安全的杀菌、消毒剂。制备ClO2的方法有多种。
(1)纤维素还原法制ClO2。其原理是:纤维素水解得到的最终产物A与NaClO3反应生成ClO2。完成反应的化学方程式:其流程如下:□ (A) +□NaClO3+□H2SO4=□ClO2↑+□CO2↑+□H2O+□______
(2)电解食盐水制取ClO2 ,其流程如下:

①粗盐中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中加入试剂的顺序依次为__________(填化学式),充分反应后将沉淀一并滤去,再加入盐酸。
②食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸在发生器中反应生成ClO2 ,写出发生器中生成ClO2的化学方程式____________________。
③上述流程中,可循环利用的物质有__________;按照绿色化学原则,电解槽阴极产生的气体与方框中物质的物质的量之比为________时,原子的利用率为100%。
(3)实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程下如下:

已知:(I)A气体在标准状况下的密度为0.089g/L;
(Ⅱ)气体B能使湿润的红色石蕊试纸变蓝。
①电解时,发生反应的化学方程式为 。
②NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:选择题
在KClO3+6HCl=3Cl2↑+ KCl +3H2O中,有30 mole-转移,生成的氯气在标准状况下的体积为
A.22.4L B.336.0L C.403.2L D.672.0L
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高一上学期学期期末化学试卷(解析版) 题型:填空题
(6分)分析下列反应:3S+6 KOH = 2K2S+K2SO3+3H2O,据此作答:
(1)用双线桥标出该反应中电子的转移方向和数目:3S +6 KOH = 2K2S+K2SO3+3H2O
(2)该反应的氧化产物是 。
(3)该反应的氧化剂与还原剂的质量比是 。
(4)当消耗0.3 mol S时,则转移的电子数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com