
二氧化氯(ClO2)为一种黄绿色气体,是一种高效、广谱、安全的杀菌、消毒剂。制备ClO2的方法有多种。
(1)纤维素还原法制ClO2。其原理是:纤维素水解得到的最终产物A与NaClO3反应生成ClO2。完成反应的化学方程式:其流程如下:□ (A) +□NaClO3+□H2SO4=□ClO2↑+□CO2↑+□H2O+□______
(2)电解食盐水制取ClO2 ,其流程如下:

①粗盐中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中加入试剂的顺序依次为__________(填化学式),充分反应后将沉淀一并滤去,再加入盐酸。
②食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸在发生器中反应生成ClO2 ,写出发生器中生成ClO2的化学方程式____________________。
③上述流程中,可循环利用的物质有__________;按照绿色化学原则,电解槽阴极产生的气体与方框中物质的物质的量之比为________时,原子的利用率为100%。
(3)实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程下如下:

已知:(I)A气体在标准状况下的密度为0.089g/L;
(Ⅱ)气体B能使湿润的红色石蕊试纸变蓝。
①电解时,发生反应的化学方程式为 。
②NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(1)1 C6H12O6+24 NaClO3+12H2SO4=24 ClO2↑+6 CO2↑+18H2O+12 Na2SO4;(2)①BaCl2、NaOH和Na2CO3或NaOH、BaCl2和Na2CO3;②2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O;③NaCl、Cl2,6︰5;(3)①NH4Cl+2HCl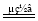 3H2↑+NCl3;②NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-。
3H2↑+NCl3;②NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-。
【解析】
试题分析:((1)纤维素水解的最终产物是葡萄糖(C6H12O6),C6H12O6中O是-2价、H是+1价、C是0,C由0价→+4价,化合价升高被氧化,葡萄糖作还原剂,NaClO3中Cl由+5→+4,化合价降低,被还原,是氧化剂,C6H12O6→CO2↑24,NaClO3→ClO2↑1,最小公倍数是24,C6H12O6系数是1,根据碳原子守恒CO2的系数6NaClO3系数24,ClO2的系数24,根据反应前后电荷守恒和原子个数守恒H+系数24,H2O系数36,反应的离子方程式:C6H12O6+24ClO3-+24H+=24ClO2↑+6CO2↑+18H2O,化学反应方程式:C6H12O6+24 NaClO3+12H2SO4=24 ClO2↑+6 CO2↑+18H2O+12 Na2SO4;(2)①粗盐的提纯不能引入新杂质:Ca2+用Na2CO3除去、Mg2+用NaOH除去、SO42-用BaCl2除去,除杂试剂需过量Na2CO3、NaOH用盐酸除去,而BaCl2需要用Na2CO3除去,即Na2CO3应放在BaCl2的后面,因此所加试剂的顺序:NaOH、BaCl2、Na2CO3或BaCl2、NaOH、Na2CO3或BaCl2、Na2CO3、NaOH;②NaClO3和盐酸反应:Cl的价态+5、-1有中间价态,按照氧化还原反应的规律NaClO3→ClO2,HCl一部分→Cl2,另一部分显酸性,NaClO3→ClO2↑1,2HCl→Cl2↑2,最小公倍数是2,NaClO3、ClO2的系数为2,Cl2的系数为1,然后根据原子个数和元素守恒,得出:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O;根据电解食盐水流程图:NaCl电解槽得到物质NaClO3、H2,ClO2发生器中得到物质ClO2、Cl2、NaCl,循环使用的物质是NaCl、Cl2,氯化钠电解槽 中发生的反应:NaCl+3H2O NaClO3+3H2↑,ClO2发生器中:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,氯化氢的合成器中:H2+Cl2=2HCl,根据反应的过程,达到原子利用率100%,阴极产生的H2和补充的H2O、Cl2物质的量之比6:5;(3)①(I)A气体标况下的密度0.089g·L-1,根据M=22.4ρ标=22.4×0.089=2,得出A气体为H2,根据电解的原理,H2应在阴极产生,电极反应式:2H++2e-=H2↑,根据流程图:NH4Cl→NCl3化合价升高,说明NH4Cl在阳极上失电子,发生的反应式:3Cl-+NH4+-6e-=NCl3+4H+,得失电子数目守恒两式相加得:NH4+3Cl-+2H+
NaClO3+3H2↑,ClO2发生器中:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,氯化氢的合成器中:H2+Cl2=2HCl,根据反应的过程,达到原子利用率100%,阴极产生的H2和补充的H2O、Cl2物质的量之比6:5;(3)①(I)A气体标况下的密度0.089g·L-1,根据M=22.4ρ标=22.4×0.089=2,得出A气体为H2,根据电解的原理,H2应在阴极产生,电极反应式:2H++2e-=H2↑,根据流程图:NH4Cl→NCl3化合价升高,说明NH4Cl在阳极上失电子,发生的反应式:3Cl-+NH4+-6e-=NCl3+4H+,得失电子数目守恒两式相加得:NH4+3Cl-+2H+ NCl3+3H2↑,发生的化学反应方程式:NH4Cl+2HCl
NCl3+3H2↑,发生的化学反应方程式:NH4Cl+2HCl 3H2↑+NCl3;气体B能使湿润的红色石蕊试纸变蓝,B:NH3,NCl3与NaClO2按物质的量之比1:6混合,也就是NCl3的系数是1,NaClO2的系数是6,根据反应前后元素守恒和原子个数守恒,NH3系数是1,ClO2的系数是6,反应离子方程式:NCl3+6ClO-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-。
3H2↑+NCl3;气体B能使湿润的红色石蕊试纸变蓝,B:NH3,NCl3与NaClO2按物质的量之比1:6混合,也就是NCl3的系数是1,NaClO2的系数是6,根据反应前后元素守恒和原子个数守恒,NH3系数是1,ClO2的系数是6,反应离子方程式:NCl3+6ClO-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-。
考点:考查氧化还原方程式的配平、除杂的步骤、电解原理、原电池原理等相关知识。
考点分析: 考点1:电解池 考点2:物质的制备 考点3:卤素 试题属性

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:2014-2015学年湖北省稳派教育高三一轮复习质量检测理科综合化学试卷(解析版) 题型:选择题
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。五种元素核电荷数之和为49,最外层电子数之和为17;工业上制取金属Y一般通过电解其与W形成的化合物方法;W、Z最外层电子数相同,Z的核电荷数是W的2倍。则下列说法不正确的是
A.Q、W、Z、Y、X原子半径依次增大
B.元素W与元素Z的最高化合价相同
C.Q和X形成的化合物中含有离子键
D.Z元素的简单离子与含有Y元素的离子在水溶液中可能大量共存
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三3月联考化学试卷(解析版) 题型:推断题
选考【化学-选修有机化学基础】(15分)
H是一种新型香料的主要成分之一,其结构中含有三个六元环。H的合成路线如下(部分产物和部分反应条件略去):

已知:
①B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
②
③D和G是同系物
请回答下列问题:
(1)用系统命名法命名(CH3)2C=CH2 : 。
(2)A→B反应过程中涉及的反应类型有 。
(3)写出D分子中含有的官能团名称: 。
(4)写出生成F与足量氢氧化钠溶液在加热条件下反应的化学方程式: 。
(5)写出E在铜催化下与O2反应生成物的结构简式: 。
(6)同时满足下列条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的G的同分异构体有 种(不包括立体异构),其中核磁共振氢谱为5组峰的为 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长望浏宁四县高三一模考试化学试卷(解析版) 题型:填空题
(14分)磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g) ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
a、写出由磷酸钙矿制取白磷总的反应方程式_____________________________。
b、上述反应中SiO2起何作用?______________________________________。
(2)白磷在热的浓氢氧化钾溶液中岐化得到一种次磷酸盐(KH2PO2)和一种气体 (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在 之间 (已知磷酸的各级电离常数为:K1 = 7.1×103 K2 = 6.3×108 K3 =4.2×1013 lg7.1≈0.9 lg6.3≈0.8 lg≈0.6) 。Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是 (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长望浏宁四县高三一模考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法错误的是

A.一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA
B.256g S8分子中含S-S键为7NA个
C.由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个
D.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省七市教科研协作体高三3月联考化学试卷(解析版) 题型:选择题
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同。25℃时,0.1mol/LX和W形成化合物的水溶液pH=1。下列说法正确的是
A.Z与Y、Z与W形成的化合物的化学键完全相同
B.Y、Z、W三种元素组成的化合物的水溶液可能显碱性
C.简单离子的半径:Z﹥R﹥W﹥Y
D.因非金属Y﹥R,所以X与Y组成化合物的沸点低于X与R组成的化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:计算题
(8分)将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是 g)

求:
(1)加入NaOH溶液0--20mL过程中反应方程式为:______。
160--180mL过程中反应方程式为_______________________。
(2)合金中Mg的质量为____________g。所用HCl 的物质的量浓度为____________mol/L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三下学期开学联考化学试卷(解析版) 题型:选择题
下列四种基本类型的反应中,一定是氧化还原反应的是
A.分解反应 B.置换反应 C.复分解反应 D.化合反应
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省资阳市高一上学期学期期末化学试卷(解析版) 题型:选择题
下列有关物质的性质或用途的说法中,正确的是
① 氯气具有漂白性,可以使有色布条褪色
② 明矾在水中能生成Al(OH)3胶体,可用作净水剂
③ Si可用于制造光导纤维
④ SiO2、Na2CO3和CaCO3可用于制玻璃
⑤ 水玻璃可用于生产防火材料
⑥ 铁红常用作红色油漆和涂料
A.①②③⑤ B.②④⑤⑥ C.③④⑤⑥ D.①③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com