
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��H2��g��+ ![]() O2��g���TH2O��l����H=��285.8kJmol��1
O2��g���TH2O��l����H=��285.8kJmol��1
��H2��g��+ ![]() O2��g���TH2O��g����H=��241.8kJmol��1
O2��g���TH2O��g����H=��241.8kJmol��1
��C��s��+ ![]() O2��g���TCO��g����H=��110.5kJmol��1
O2��g���TCO��g����H=��110.5kJmol��1
��C��s��+O2��g���TCO2��g����H=��393.5kJmol��1
�ش����и����⣺
��1��������Ӧ�����ڷ��ȷ�Ӧ���� ��
��2��H2��ȼ����Ϊ��C��ȼ����Ϊ ��
��3��ȼ��10g H2����Һ̬ˮ���ų�������Ϊ ��
��4��COȼ�յ��Ȼ�ѧ����ʽΪ����ȼ���ȡ�HΪ ��
���𰸡�
��1���٢ڢۢ�
��2��285.8kJ?mol��1��393.5kJ?mol��1
��3��1429.0kJ
��4��CO��g��+O2��g���TCO2��g����H=��283.0kJ?mol��1����283.0kJ?mol��1
���������⣺��1�����ʵ�ȼ�վ�Ϊ���ȷ�Ӧ�����٢�Ϊ������ȼ�գ��ۢ�ΪC��ȼ�գ��ʢ٢ڢܾۢ�Ϊ���ȷ�Ӧ�����Դ��ǣ��٢ڢۢܣ���2��ȼ������ָ��101kPʱ��1mol��ȼ����ȫȼ�������ȶ���������ʱ���ų���������CԪ��ת��ΪCO2 �� HԪ��ת��ΪҺ̬ˮ���ʷ�Ӧ��Ϊ������ȼ���ȵ��Ȼ�ѧ����ʽ����������ȼ����Ϊ285.8kJmol��1����Ӧ��ΪC��ȼ���ȵ��Ȼ�ѧ����ʽ����C��ȼ����Ϊ393.5kJmol��1 �� ���Դ��ǣ�285.8 kJmol��1��393.5kJmol��1����3��10g���������ʵ���Ϊ5mol����1mol����ȼ������Һ̬ˮʱ�ų�285.8KJ����5mol����ȼ������Һ̬ˮʱ�ų�������Ϊ285.8kJmol��1��5mol=1429.0 kJ�����Դ��ǣ�1429.0kJ�� ��4�����ݸ�˹���ɿ�֪�����ܩ��ۿɵ�CO��ȼ�շ�ӦΪ��CO��g��+O2��g���TCO2��g����H=��283.0 kJmol��1 �� ��CO��ȼ���ȡ�HΪ��283.0 kJmol��1 �� ���Դ��ǣ�CO��g��+O2��g���TCO2��g����H=��283.0 kJmol��1����283.0 kJmol��1 ��
�����㾫����ͨ������������ȷ�Ӧ�ͷ��ȷ�Ӧ�ͷ�Ӧ�Ⱥ��ʱ䣬���ջ�ѧ�ϰ����������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ����ѧ�ϰѷų������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ���ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȼ����Խ����⣮


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܸ߷���P�ĺϳ�·�����£�
��1��A�ķ���ʽ��C7H8 �� ��ṹ��ʽ�� ��
��2���Լ�a�� ��
��3����Ӧ�۵Ļ�ѧ����ʽ�� ��
��4��E�ķ���ʽ��C6H10O2 �� E�к��еĹ����ţ� ��
��5����Ӧ�ܵķ�Ӧ������ ��
��6����Ӧ�ݵĻ�ѧ����ʽ�� ��
��7����֪��2CH3CHO 
����ϩΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�E��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л�����ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����14gͭ���Ͻ�������ijŨ�ȵ����ᷴӦ��ʹ�ų���������1.12L����״�����������ǡ�ñ�ˮȫ�������������ᣬ��Ͻ���ͭ������Ϊ�� ��
A.3.2g
B.4.43g
C.10.8g
D.12.4g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и����������ʣ� A��O2��O3
B. ![]() C��
C�� ![]() C
C
C��CH3CH2CH2CH3�� ![]()
D�� 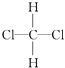 ��
�� 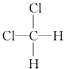
E��CH3CH2CH2CH3�� ![]()
��1����������������ͬϵ�
��2�����������ʻ�Ϊͬ�������壮
��3���������ʻ�Ϊͬ���칹�壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ���Ҫ���������ʽṹ����ش��������⡣
��1����֪A��BΪ��������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
������/kJ��mol��1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
Aͨ�����ۣ�BԪ�صĺ�������Ų�ʽΪ��
��2������Ϊ300nm�����Ĺ��������е�����ԼΪ399 kJ��mol��1�������±��йص����ʷ�������Ҫ��ѧ������Ϣ��˵�����峤ʱ������������Ƥ�������˺���ԭ��������ɵ����ʵ���İ������е�̼ԭ���ӻ���������
���ۼ� | C��C | C��N | C��S |
����/ kJ��mol��1 | 347 | 305 | 259 |
��3��ʵ��֤����KCl��MgO��CaO��TiN��4�־���Ľṹ
��NaCl����ṹ���ƣ�����ͼ��ʾ������֪3�����Ӿ���ľ������������±���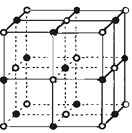
���Ӿ��� | NaCl | KCl | CaO |
������/kJ��mol��1 | 786 | 715 | 3401 |
���4�����Ӿ��壨������NaCl���۵�Ӹߵ��͵�˳����������MgO������һ��Mg2����Χ�������ڽ��ҵȾ����Mg2��������
��4�����������Ӻ�δ�ɶԵ���Խ�࣬�����Խ�ż�¼����Խ�á�������������V2O5��CrO2�У��ʺ���¼�����ŷ�ԭ�ϵ�����
��5��ij�����ķ��ӽṹ����ͼ��ʾ��������ڲ�����������ţ���
A.���Ӽ�
B.���Լ�
C.������
D.���
E.���
F.�Ǽ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Ļ��Գɷ֣�����Ԥ�����ಡ��Ҳ�ܻ��⼡��ؽ���ʹ�����������������Ľṹ���Ա�ʾΪ��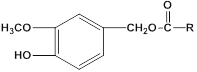 (RΪ����)������һ���������������J�ĺϳ�·�����£�
(RΪ����)������һ���������������J�ĺϳ�·�����£�
��֪��
��A��B��EΪͬϵ�����B����Է�������Ϊ44��A��B�˴Ź���������ʾ��������壻
�ڻ�����J�ķ���ʽΪC15H22O4��
��  +H2O
+H2O
�ش��������⣺
��1��G���������ŵ�����Ϊ��
��2����A��B����C�Ļ�ѧ����ʽΪ��
��3����C����D�ķ�Ӧ����Ϊ �� D�Ļ�ѧ����Ϊ��
��4����H����I�Ļ�ѧ����ʽΪ��
��5��J�Ľṹ��ʽΪ��
��6��G��ͬ���칹���У������ϵ�һ�ȴ���ֻ��һ�ֵĹ�����(���������칹)���˴Ź���������ʾ2������(д�ṹ��ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��Ӧ���ʵ���Ҫԭ���ǣ� ��
A.�μӷ�Ӧ�ﱾ��������
B.�������
C.�¶Ⱥ�ѹǿ
D.����Ӧ����������Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A.�������̺�Ũ���ᷴӦ��MnO2+4HCl��Ũ�� ![]() ?Mn2++2Cl2��+2H2O
?Mn2++2Cl2��+2H2O
B.ϡ�����������Һ��Ӧ��SiO32��+2H+�TH2SiO3��
C.̼��ƺ�ϡ���ᷴӦ��CO32��+2H+�TCO2��+H2O
D.ͭ���Ȼ�����Һ��Ӧ��Fe3++Cu�TFe2++Cu2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���ҹ���ɫ�������ϵ������н����������㷺��Ӧ���ڵ�������е���졢���������ش��������⣺
��ͭԭ�ӻ�̬�����Ų�ʽΪ�����þ����x�������䷨���Բ�ð���٤���������Խ���ͭ�IJⶨ�õ����½��������Ϊ�����������ܶѻ����߳�Ϊ361pm����֪ͭ���ܶ�Ϊ9.00gcm��3 �� ��٤������Ϊ����ʽ���㣬���������λ��Ч���֣�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com