
����Ŀ�������������ʵ���Ҫ���������ʽṹ����ش��������⡣
��1����֪A��BΪ��������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
������/kJ��mol��1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
Aͨ�����ۣ�BԪ�صĺ�������Ų�ʽΪ��
��2������Ϊ300nm�����Ĺ��������е�����ԼΪ399 kJ��mol��1�������±��йص����ʷ�������Ҫ��ѧ������Ϣ��˵�����峤ʱ������������Ƥ�������˺���ԭ��������ɵ����ʵ���İ������е�̼ԭ���ӻ���������
���ۼ� | C��C | C��N | C��S |
����/ kJ��mol��1 | 347 | 305 | 259 |
��3��ʵ��֤����KCl��MgO��CaO��TiN��4�־���Ľṹ
��NaCl����ṹ���ƣ�����ͼ��ʾ������֪3�����Ӿ���ľ������������±���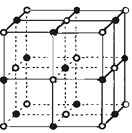
���Ӿ��� | NaCl | KCl | CaO |
������/kJ��mol��1 | 786 | 715 | 3401 |
���4�����Ӿ��壨������NaCl���۵�Ӹߵ��͵�˳����������MgO������һ��Mg2����Χ�������ڽ��ҵȾ����Mg2��������
��4�����������Ӻ�δ�ɶԵ���Խ�࣬�����Խ�ż�¼����Խ�á�������������V2O5��CrO2�У��ʺ���¼�����ŷ�ԭ�ϵ�����
��5��ij�����ķ��ӽṹ����ͼ��ʾ��������ڲ�����������ţ���
A.���Ӽ�
B.���Լ�
C.������
D.���
E.���
F.�Ǽ��Լ�
���𰸡�
��1��+3��1s22s22p63s2
��2���������е������ȵ����ʷ�������Ҫ��ѧ��C��C��C��N��C��S�ļ��ܶ�����������������ʹ��Щ��ѧ�����ѣ��Ӷ��ƻ������ʷ��ӣ�sp2��sp3
��3��TiN��MgO��CaO��KCl��12
��4��CrO2
��5��A,C
���������⣺��1��A��I4������ͻȻ����˵���������3�����ӣ�ӦΪAl��B��I3������ͻȻ����˵���������2�����ӣ�ӦΪMg��Al�������ϼ�Ϊ+3�ۣ�Mg�ĺ�����12�����ӣ��������Ų���������Ų�ʽΪ��1s22s22p63s2��
���Դ��ǣ�+3��1s22s22p63s2��
��2������Ϊ300nm�������Ĺ��������е�����ԼΪ399kJ/mol���ȵ����ʷ�����C-C��C-N��C-S�ļ��ܶ������Բ���Ϊ300nm�������Ĺ������ƻ������ʷ����еĻ�ѧ�����Ӷ��ƻ������ʷ��ӣ���ɵ����ʵ���İ������е�̼ԭ���ӻ�������sp2��sp3�����Դ��ǣ��������е������ȵ����ʷ�������Ҫ�Ļ�ѧ��C-C��C-N��C-S�ļ��ܶ�����������������ʹ��Щ��ѧ�����ѣ��Ӷ��ƻ������ʷ��ӣ�sp2��sp3��
��3�� ���Ӿ����о�����Խ���γɵ����Ӿ���Խ�ȶ����۵�Խ��Ӳ��Խ�����������ӵİ뾶������йأ����Խ�ࡢ���Ӱ뾶ԽС��������Խ��TiN���������� �������Ϊ3��������������������ɣ�MgO��CaO�����������ͬ����þ���Ӱ뾶С�ڸ����Ӱ뾶���Ȼ��������������������Ϊ1���Ҽ����Ӱ뾶�������� �뾶�������Ӱ뾶���������Ӱ뾶������KCl��MgO��CaO��TiN4�����Ӿ����۵�Ӹߵ��͵�˳����TiN��MgO��CaO��KCl��
MgO�ľ���ṹ��NaCl�ľ���ṹ���ƣ�����һ��Mg2+��Χ�������ڽ��ҵȾ����Mg2+����Ϊ12��
���Դ��ǣ�TiN��MgO��CaO��KCl��12��
��4��V2O5��V����������ȫ��ʧȥ��ɼ���CrO2��Crʧȥ4�����ӣ����ӵ���������Ϊ2��Ϊ�ɶԣ����Ӻ�δ�ɶԵ���Խ�࣬�����Խ�����ʺ���¼�����ŷ�ԭ�ϵ���CrO2 ��
���Դ��ǣ�CrO2��
��5����������д��ڵĻ�ѧ���У��ǽ���Ԫ��֮��Ĺ��ۼ�����Ԫ���뵪Ԫ��֮�����λ������ԭ�Ӻ���ԭ��֮����������ѡAC��
���Դ���AC��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2SO3��Һ�Ͳ�ͬ��������������Һ��Ϊʵ�����̽���ε����ʺ�����Һ�䷴Ӧ�Ķ����ԣ�
ʵ�� | �Լ� | ���� | |
�ι� | �Թ� | ||
| 0.2 molL��1 Na2SO3��Һ | ����Ag2SO4��Һ | ������ɫ���� |
0.2 molL��1 CuSO4 | ����Һ���̣������μӲ����ػ�ɫ���� | ||
0.1 molL��1 Al2��SO4��3��Һ | ��ʼ�����Ա仯�������μӲ�����ɫ���� | ||
��1�������飬������еİ�ɫ������Ag2SO3 �� �����ӷ���ʽ��������� ��
��2�������飬�������ػ�ɫ�����в���SO42�� �� ����Cu+��Cu2+��SO32�� �� ��֪��Cu+![]() Cu+Cu2+ �� Cu2+
Cu+Cu2+ �� Cu2+![]() CuI������ɫ��+I2 ��
CuI������ɫ��+I2 ��
����ϡ����֤ʵ�����к���Cu+��ʵ�������� ��
��ͨ������ʵ��֤ʵ�������к���Cu2+��SO32�� �� 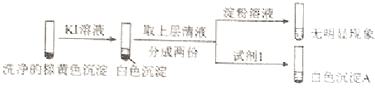
a����ɫ����A��BaSO4 �� �Լ�1�� ��
b��֤ʵ�����к���Cu+��SO32���������� ��
��3����֪��Al2��SO3��3��ˮ��Һ�в����ڣ������飬�����İ�ɫ��������SO42�� �� �ð�ɫ������������ǿ�ᣬ��������ǿ�����ʹ����KMnO4��Һ��ɫ��
���Ʋ�����к������������ ��
�ڶ��ڳ�������������Ĵ�����ʽ������ּ��裺i����Al��OH��3��������ii�����������ļ�ʽ���У��Լ���ii����˶Ա�ʵ�飬֤ʵ�˼���ii������
a�����Ա�ʵ�鷽������������
����һ��
�����������ͼ��ʽ���֣���
b������ii������ʵ��֤����
��4������ʵ�飬�������ε������� �� ����Һ�䷴Ӧ�Ķ��������йأ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������棨CeO2����һ����Ҫ��ϡ�������ƽ�������ʾ�����������в��������ķϲ� ����ĩ����SiO2��Fe2O3��CeO2�����ʣ���ij����С���Դ˷�ĩΪԭ�ϣ������Դ���յĹ����������£� 
��1��д���ڢٲ���Ӧ�����ӷ���ʽ��
��2��ϴ������B��Ŀ����Ϊ�˳�ȥ�������ӷ��ţ�������������Ƿ�ϴ���ķ�������
��3��д���ڢ۲���Ӧ�Ļ�ѧ����ʽ��
��4���Ʊ��̷�(FeSO4��7H2O)ʱ����Fe2(SO4)3��Һ�м��������м����ַ�Ӧ�����˵õ�FeSO4��Һ���پ��������ˡ�ϴ�ӡ�����Ȳ�������õ��̷���
��5��ȡ���������еõ���Ce(OH)4��Ʒ(��������Ϊ86%)1.000g���������ܽ����0.1000mol/L FeSO4��Һ�ζ����յ㣨�汻��ԭ��Ce3+��������ȷ�μӱ���Һ�����ΪmL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���;�������
A. ��������̫���ܵ�صij��ò��� B. ����������������ά�IJ���
C. ˮ����������ľ�ķ���� D. ������ȡˮ���ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ���仯����һ��������Ͷ���������Ⱦ����þԭ��طŵ�ʱ��ѹ�߶�ƽ�ȣ�ʹþԭ���Խ��Խ��Ϊ����������ɫԭ��صĹ�ע���㣮����һ��þԭ��صķ�ӦΪ��xMg+Mo3S4 ![]() MgxMo3S4����þԭ��طŵ�ʱ������˵��������ǣ� ��
MgxMo3S4����þԭ��طŵ�ʱ������˵��������ǣ� ��
A.Mg2+������Ǩ��
B.������ӦΪ��Mo3S4+2xe��=Mo3S42x��
C.Mo3S4����������Ӧ
D.������ӦΪ��xMg��2xe��=xMg2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��H2��g��+ ![]() O2��g���TH2O��l����H=��285.8kJmol��1
O2��g���TH2O��l����H=��285.8kJmol��1
��H2��g��+ ![]() O2��g���TH2O��g����H=��241.8kJmol��1
O2��g���TH2O��g����H=��241.8kJmol��1
��C��s��+ ![]() O2��g���TCO��g����H=��110.5kJmol��1
O2��g���TCO��g����H=��110.5kJmol��1
��C��s��+O2��g���TCO2��g����H=��393.5kJmol��1
�ش����и����⣺
��1��������Ӧ�����ڷ��ȷ�Ӧ���� ��
��2��H2��ȼ����Ϊ��C��ȼ����Ϊ ��
��3��ȼ��10g H2����Һ̬ˮ���ų�������Ϊ ��
��4��COȼ�յ��Ȼ�ѧ����ʽΪ����ȼ���ȡ�HΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ҩƷ�DZ�ˮ�����ϳ�·�����¡��ش��������⣺ ��֪��
��֪�� 
��1���DZ�ˮ��ķ���ʽΪ�������DZ�ˮ�������˵����ȷ����(�����)��
A.1 mol�DZ�ˮ������Ժ�2mol NaOH��Ӧ
B.���ܷ���������Ӧ
C.�ɷ���ˮ�ⷴӦ
D.�����巢��ȡ����Ӧ
��2��D��������
��3��A��B�����Լ�Ϊ��D��E��Ӧ���л���Ӧ��������
��4��B�� C��Ӧ�Ļ�ѧ����ʽΪ��
��5��F���ڶ���ͬ���칹�塣
�� F������ͬ���칹��������һ�ֱ�����������ʾ���źţ������ݣ���ȫ��ͬ����������(�����)��
A.������ B.��������� C.Ԫ�ط����� D.�˴Ź�����
�� F��ͬ���칹���м�����FeCl3������ɫ��Ӧ�����ܷ���������Ӧ�����ʹ���
�֣�д�����к˴Ź���������ʾ4��壬�ҷ����֮��Ϊ1:2:2:1��ͬ���칹��Ľṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A. ֱ������l��100 nm֮������ӱ���Ϊ����
B. ��Ӿ�����֤����������
C. ���ö���������������Һ�ͽ���
D. �������Ӻ�С��������ͨ����ֽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������
��1����пƬ����Ƭ����ϡ���������ԭ��أ����缫������һ�������ƣ� пƬ�Ϸ����ĵ缫��Ӧ
��Ƭ�Ϸ����ĵ缫��Ӧ
��2�����õ�������缫��������Ϊ60g������һ��ʱ���ȡ��пƬ����Ƭϴ���������أ�������Ϊ47g���Լ��㣺 �ٲ������������ �� ����״������
��ͨ�����ߵĵ��� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com