
【题目】NA代表阿伏伽德罗常数的值,下列说法不正确的是
A. 将1mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
B. 标准状况下,1L0.5molL-1乙酸溶液中含有氢离子总数为0.5NA
C. 3lg白磷分子含有共价键总数为1.5NA 已知:白磷(P4)为正四面体结构
D. 53克Na2CO3固体中含有CO32-总数为0.5NA
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】已知某温度下,Ksp(AgCl)=1.56×10-10 mol2·L-2,Ksp(Ag2CrO4)=1.12×10-12 mol3·L-3,下列叙述正确的是
A.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小
B.向2.0×10-4 mol·L-1的K2CrO4溶液中加入等体积的2.0×10-4 mol·L-1 AgNO3 溶液,则有Ag2CrO4沉淀生成
C.将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大
D.将0.001 mol·L-1的AgNO3 溶液逐滴滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4的混合溶液中,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中进行如下反应:X(g)+3Y(g)![]() 2Z(g),X、Y、Z起始浓度分别是0.2mo1/L、0.6mol/L、0.4mol/L,当达到平衡时,下列数据可能正确的是
2Z(g),X、Y、Z起始浓度分别是0.2mo1/L、0.6mol/L、0.4mol/L,当达到平衡时,下列数据可能正确的是
A. X为0.25mol/L,Z为0.5mol/L B. Y为1.2mo1/L
C. X为0.3mol/L,Z为0.3mol/L D. Z为0.6mo1/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(19分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
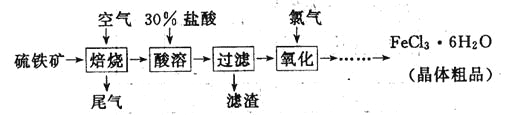
(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。
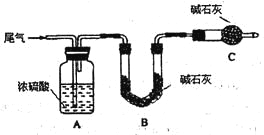
①C仪器的名称是 ,该装置的作用是 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是 。
②进行沉淀洗涤的方法是 。
③SO2含量的表达式是 (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3![]() 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同条件下,下列各组热化学方程式中,△H2>△H1的是( )
A.2H2 (g)+O2(g)═2H2O(g)△H1; 2H2(g)+O2(g)═2H2O(l)△H2
B.S(g)+O2(g)═SO2(g)△H1; S(s)+O2(g)═SO2(g)△H2
C.CO(g)+ ![]() ?O2(g)═CO2(g)△H1; 2CO(g)+O2(g)═2CO2(g)△H2
?O2(g)═CO2(g)△H1; 2CO(g)+O2(g)═2CO2(g)△H2
D.![]() ?H2(g)+
?H2(g)+ ![]() ?Cl2(g)═HCl(g)△H1;H2(g)+Cl2(g)═2HCl(g)△H2
?Cl2(g)═HCl(g)△H1;H2(g)+Cl2(g)═2HCl(g)△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C(放热)分两步进行:①A+B→X(吸热),②X→C(放热).下列示意图中,能正确表示总反应过程中能量变化的是( )
A.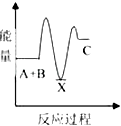
B.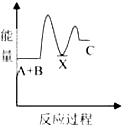
C.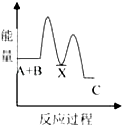
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造地球卫星上使用的一种高能电池(银锌蓄电池),其电池的电极反应式为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断氧化银是( )
A. 负极,被氧化B. 正极,被还原C. 负极,被还原D. 正极,被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com