
【题目】(19分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
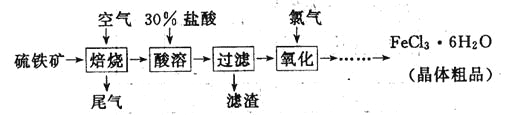
(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。
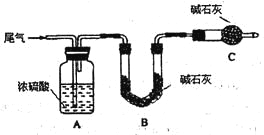
①C仪器的名称是 ,该装置的作用是 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是 。
②进行沉淀洗涤的方法是 。
③SO2含量的表达式是 (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3![]() 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
【答案】(19分)
(1)2Fe2++ Cl2= 2Cl-+ 2Fe3+(2分) KSCN溶液(1分,其它合理答案也给分)
(2)方案一:①干燥管(1分) 防止空气中的水蒸气、CO2被B装置吸收(2分)
②否(1分) 尾气中的CO2也能被B装置吸收使所测质量分数偏大(2分)
方案二:①使生成的SO42-完全转化为沉淀(2分)
②在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作(2分)
③![]() %(2分)
%(2分)
(3)蒸发浓缩(2分)
Fe3++ 3H2O![]() Fe(OH)3+ 3H+,过量盐酸能够抑制Fe3+水解(2分)
Fe(OH)3+ 3H+,过量盐酸能够抑制Fe3+水解(2分)
【解析】试题分析:(1)滤液中含有Fe2+,通入Cl2发生氧化还原反应,离子方程式为:2Fe2++ Cl2= 2Cl-+ 2Fe3+;检验Fe3+的试剂为KSCN溶液,若溶液变红,说明含有Fe3+。
(2)方案一:①根据实验装置图可知,C仪器的名称是干燥管;外界空气中含有CO2、水分,可能被B中碱石灰吸收,所以C装置的作用是:防止空气中的水蒸气、CO2被B装置吸收。
②因为尾气中含有CO2,也能办碱石灰吸收,使所测质量分数偏大,所以方案一不合理。
方案二:①溴水与SO2反应生成H2SO4,加入过量的BaCl2溶液,Ba2+与SO42反应,使生成的SO42-完全转化为沉淀。
②洗涤沉淀的方法是:在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作。
③根据化学方程式和S元素守恒可得对应关系:SO2~ BaSO4,所以SO2含量的表达式是:mg÷233g/mol×22.4L/mol÷VL×100% =![]() %
%
(3)从FeCl3溶液中得到FeCl3![]() 6H2O晶体,应蒸发浓缩,再冷却结晶、过滤,因为FeCl3为强酸弱碱盐,能发生水解反应:Fe3++ 3H2O
6H2O晶体,应蒸发浓缩,再冷却结晶、过滤,因为FeCl3为强酸弱碱盐,能发生水解反应:Fe3++ 3H2O![]() Fe(OH)3+ 3H+,过量盐酸能够抑制Fe3+水解。
Fe(OH)3+ 3H+,过量盐酸能够抑制Fe3+水解。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】把铝、铁混合物 1.1g 溶于200mL 5molL ﹣1盐酸中,反应后盐酸的浓度变为4.6molL ﹣1(溶液体积变化忽略不计).求:
(1)反应中消耗HCl的物质的量.
(2)该混合物中铝、铁的物质的量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列有关化学基本概念的依据正确的是
A.纯净物与混合物:是否仅含有一种元素
B.酸:在水溶液里电离出的阳离子全部为H+的化合物
C.电解质与非电解质:辨别依据是水溶液是否导电
D.溶液与胶体:本质区别是能否发生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3+5O24NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是( )
A.V(O2)=0.01molL﹣1s﹣1
B.V(NO)=0.008mol L﹣1s﹣1
C.V(H2O)=0.015mol L﹣1s﹣1
D.V(NH3)=0.002mol L﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏伽德罗常数的值,下列说法不正确的是
A. 将1mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
B. 标准状况下,1L0.5molL-1乙酸溶液中含有氢离子总数为0.5NA
C. 3lg白磷分子含有共价键总数为1.5NA 已知:白磷(P4)为正四面体结构
D. 53克Na2CO3固体中含有CO32-总数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇:2CO(g) + 4H2(g)![]() CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
A. CO全部转化为乙醇
B. 断4NA个H-H键的同时,生成46g乙醇
C. 若反应在恒温恒容密闭容器中进行,容器中混合气体的密度不再改变
D. 若反应在绝热恒容密闭容器中进行,容器中温度不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com