
【题目】许多金属及其化合物在生活、化工、医药、材料等各个领域有着广泛的应用。
(1)钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度,被美誉为“未来钢铁”、“战略金属”。钛基态原子中电子占据最高能级的符号为________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_______种。钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是___________________。
(2)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图所示,该晶胞中N、Ti之间的最近距离为a×10-10 cm,则该氮化钛的密度为______ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。

(3)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。Li2O是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。
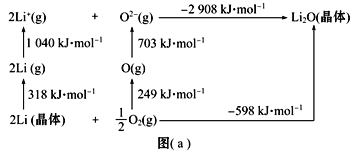
Li原子的第一电离能为______kJ·mol-1,O![]() O键键能为_____kJ·mol-1,Li2O晶格能为____kJ·mol-1。
O键键能为_____kJ·mol-1,Li2O晶格能为____kJ·mol-1。
【答案】3d 3 钛原子的价电子数比Al多,金属键更强 ![]() 520 498 2908
520 498 2908
【解析】
(1) 钛原子核外有22个电子,根据核外电子排布规律写出钛原子价电子排布式,再确定占据的最高能级;基态Ti原子的未成对电子数为2;第四周期中未成对电子数为2的元素有Ge、Se、Ni,有3种;钛原子的价电子数是4、铝原子的价电子数是3;
(2) 根据均摊法,可知该晶胞中N原子个数为6![]() +8
+8![]() =4,Ti原子个数为1+12
=4,Ti原子个数为1+12![]() =4,所以晶胞的质量为m=
=4,所以晶胞的质量为m=![]() g,而晶胞的体积V=(2a×10-10)3cm3,再根据
g,而晶胞的体积V=(2a×10-10)3cm3,再根据![]() =
=![]() 计算;
计算;
(3) Li原子的第一电离能是指1mol气态锂原子失去1mol电子变成1mol气态锂离子所吸收的能量;O![]() O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量;晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,以此解答。
O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量;晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,以此解答。
(1) 钛原子核外有22个电子,基态钛原子价电子排布式为3d24s2,占据最高能级的符号为3d;基态原子的未成对电子数为2;第四周期中未成对电子数为2的元素有Ge、Se、Ni,有3种;钛原子的价电子数是4、铝原子的价电子数是3,钛原子的价电子数比铝多,金属键更强,所以钛的硬度比铝大;
因此,本题正确答案是:3d;3;钛原子的价电子数比Al多,金属键更强;
(2) 根据均摊法,可知该晶胞中N原子个数为6![]() +8
+8![]() =4,Ti原子个数为1+12
=4,Ti原子个数为1+12![]() =4,所以晶胞的质量为m=
=4,所以晶胞的质量为m=![]() g,而晶胞的体积V=(2a×10-10)3cm3,所以晶胞的密度
g,而晶胞的体积V=(2a×10-10)3cm3,所以晶胞的密度![]() =
=![]() g·cm-3,
g·cm-3,
因此,本题正确答案是:![]() ;
;
(3) Li原子的第一电离能是指1mol气态锂原子失去1mol电子变成1mol气态锂离子所吸收的能量,即为![]() =520kJ·mol-1;O=O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量,即为249kJ·mol-1
=520kJ·mol-1;O=O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量,即为249kJ·mol-1![]() =498 kJ·mol-1。晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,则Li2O晶格能为2908kJ·mol-1。
=498 kJ·mol-1。晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,则Li2O晶格能为2908kJ·mol-1。
因此,本题正确答案是:520 ;498 ;2908。


科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是( )
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 该流程中可循环利用的物质是NH4Cl
D. 高氯酸铵中氯元素的化合价为+7价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NH4HCO3![]() NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
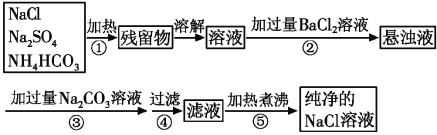
(1)操作④中所需的玻璃仪器有_________________________________。
(2)操作②为什么不用硝酸钡溶液,其理由是________________________________。
(3)进行操作②后,如何判断SO![]() 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(4)操作③的目的是__________,其相应的离子方程式为:____________________。
(5)说明此设计方案不严密之处____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水含大量的FeSO4,较多的Cu2+和少量的K+。某工厂计划回收金属铜并制取硫酸亚铁,流程如下图,相关分析错误的是( )

A.步骤①加入过量Fe粉后过滤,分别得到固体A和滤液B
B.步骤②所加试剂是稀盐酸
C.蒸发结晶时有大量晶体析出就停止加热
D.取少量步骤①所得溶液B于试管中,先加入盐酸酸化,再加入BaCl2溶液,有白色沉淀生成,表明溶液B中含SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10mL98%浓硫酸(密度为1.84g/mL)加水稀释至1L,然后向溶液中加入6.5g锌粒。
(1)稀释后硫酸溶液中H+的物质的量浓度是_________________?
(2)标出反应中电子转移方向及数目___________,并计算生成气体在标况下的体积是_____________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如下图所示(电极未标出),下列说法错误的是:
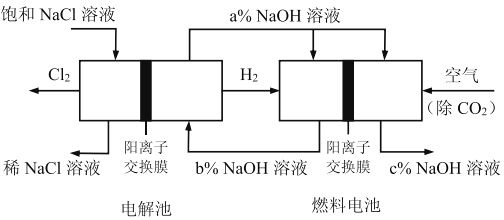
A. 电解池的阴极反应式2H2O+2e-=H2+2OH-
B. 相同条件下,当电解池生成2LCl2,理论上燃料电池应消耗1LO2
C. 电解池中阳离子移动流向阴极池
D. 溶液a、b、c的pH大小顺序为:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的液化可以合成甲醇。
①“气化”:C(s)+2H20(g)=C02(g)+2H2(g) △H1=+90.1kJ·mol-1
②催化液化Ⅰ:CO2(g)+3H2(g)=CH30H(g)+H20(g)△H2=-49.0kJ·mol-1
③催化液化Ⅱ:C02(g)+2H2(g)=CH30H(g)+1/2O2(g)△H3=akJ·mol-1
下列有关说法正确的是

A. 催化液化Ⅰ中使用催化剂,反应的活化能Ea、△H2都减小
B. 反应C(s)+H20(g)+H2(g)=CH3OH(g) △H=+41.1kJ·mol-1
C. △H2>△H3
D. 甲醇燃料电池的工作原理示意图如图所示,负极的电极反应为CH3OH-6e-+6OH-=CO2↑+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T ℃时,NH3+NH3![]() NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为1×10-14
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com