
【题目】将10mL98%浓硫酸(密度为1.84g/mL)加水稀释至1L,然后向溶液中加入6.5g锌粒。
(1)稀释后硫酸溶液中H+的物质的量浓度是_________________?
(2)标出反应中电子转移方向及数目___________,并计算生成气体在标况下的体积是_____________?
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】对下图的表达中正确的是( )

A.图a可以表示t s时,N2(g)+3H2(g) ![]() 2NH3(g)达到了平衡
2NH3(g)达到了平衡
B.图b中所介绍的电池使用后不能投入火中,应埋入地下以防污染环境
C.图c可表示某化学反应属于放热反应,放出的能量为E2-E1
D.图d涉及的反应可能为M![]() N
N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:
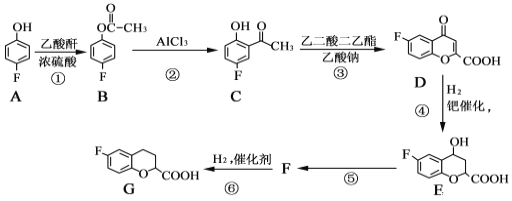
已知:乙酸酐的结构简式为![]() 。
。
请回答下列问题:
(1)A的名称是_________________;B中所含官能团的名称是____________。
(2)反应⑤的化学方程式为____________________________,反应①的反应类型是_______________。
(3)D 的分子式为_____________。
(4)写出满足下列条件的E的同分异构体的结构简式:_________ 、________。
Ⅰ.苯环上只有三个取代基
Ⅱ.核磁共振氢谱图中只有4组吸收峰
Ⅲ.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 为原料制备
为原料制备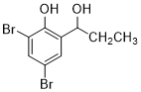 的合成路线流程图(无机试剂任选)___________________合成路线流程图示:CH3CH2Br
的合成路线流程图(无机试剂任选)___________________合成路线流程图示:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.0 kJ·mol1
2NO(g) ΔH=+180.0 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热为 _________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为 ____________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A.2υ正(NO2)=υ逆(N2)
B. 混合气体的平均相对分子质量保持不变
C.气体总压强不再变化
D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___molL1min1。
③25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
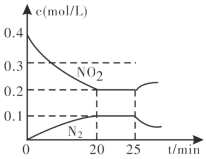
A.缩小容器体积
B.增加NO2的浓度
C.降低温度
D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某种原子的质量是a g,若NA只表示阿伏伽德罗常数的数值,该原子的相对原子质量为______,b g该原子的物质的量为______mol。
(2)a g A气体与b g B气体分子数相等,同温同压下,气体A与气体B的密度之比为___________。
(3)向10 mL 0.1mol/LNaHCO3溶液中缓缓滴入0.1mol/LCa(OH)2溶液,首先发生反应的两种离子为____________(填离子符号,下同),随后溶液中有白色沉淀生成,生成沉淀的两种离子为____________。当加入少量Ca(OH)2溶液时,发生的离子反应方程式为_______________________。
(4) 将3.22 g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需加入水的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多金属及其化合物在生活、化工、医药、材料等各个领域有着广泛的应用。
(1)钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度,被美誉为“未来钢铁”、“战略金属”。钛基态原子中电子占据最高能级的符号为________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_______种。钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是___________________。
(2)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图所示,该晶胞中N、Ti之间的最近距离为a×10-10 cm,则该氮化钛的密度为______ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。

(3)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。Li2O是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。
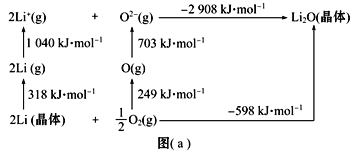
Li原子的第一电离能为______kJ·mol-1,O![]() O键键能为_____kJ·mol-1,Li2O晶格能为____kJ·mol-1。
O键键能为_____kJ·mol-1,Li2O晶格能为____kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
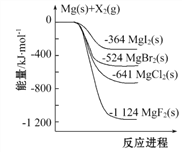
A. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方 程式为:MgBr2(s)+Cl2(g)![]() MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
B. 热稳定性: MgI2 > MgBr2 > MgCl2 > MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四室式电渗析法制备盐酸和NaOH的装置如图所示。a、b、c 为阴、阳离子交换膜。已知:阴离子交换膜只允许阴离子透过,阳离子交换膜只允许阳离子透过。下列叙述正确的是( )
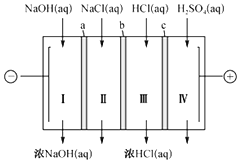
A. b、c 分别依次为阳离子交换膜、阴离子交换膜
B. 通电后Ⅲ室中的Cl-透过c 迁移至阳极区
C. Ⅰ、Ⅱ、Ⅲ、Ⅳ四室中的溶液的pH均升高
D. 电池总反应为4NaCl+6H2O![]() 4NaOH+4HCl+2H2↑+O2↑
4NaOH+4HCl+2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】就如图所示的转化关系及现象,完成下列问题:
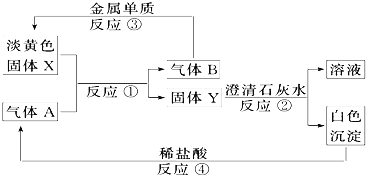
(1)固体X的名称为_______________,A的化学式为_____________。
(2)写出反应①③的化学方程式。
①___________________________。③___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com