
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | ② | O |
| 原子结构 示意图 |  | ③ |  |
| 周期 | 三 | 三 | 二 |
| 族 | IA | ⅦA | ④ |
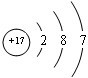 ,②元素符号为Cl;
,②元素符号为Cl;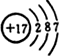 ; ④VIA;
; ④VIA;

科目:高中化学 来源: 题型:
| A组 | B组 |
| Ⅰ.H-I键键能大于H-Cl键键能 | ①HI比HCl稳定 |
| Ⅱ.水分子之间可以形成氢键 | ②水分子很稳定 |
| Ⅲ.HI分子间作用力大于HCl分子间作用力 | ③HI沸点比HCl低 |
| Ⅳ.氨分子与水分子之间可以形成氢键 | ④氨极易溶于水 |
| A、Ⅰ① | B、Ⅱ② | C、Ⅲ③ | D、Ⅳ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
. |
| M |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤的干馏和石油的分馏均属化学变化 |
| B、BaSO4在医学上用作钡餐,Ba 2+ 对人体无毒 |
| C、由油脂得到甘油和由淀粉得到葡萄糖均发生了水解反应 |
| D、葡萄糖注射液不属于胶体,其本质原因是由于不能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( )
Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( )| A、3:3:3 |
| B、3:2:1 |
| C、1:1:1 |
| D、3:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中除稀有气体外电负性最小的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| … | W | |||
| X | Y | … | Z |
| A、X、Y、Z、W的原子半径依次减小 |
| B、W与X形成的化合物中只含离子键 |
| C、W的气态氢化物的稳定性小于Z的气态氢化物的稳定性 |
| D、W与Y形成的化合物可分别与NaOH溶液和盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤ | B、①②⑤ |
| C、①⑤⑥ | D、①②③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com