
【题目】正在研发的锂空气电池能量密度高、成本低,可作为未来电动汽车的动力源,其工作原理如图。下列有关该电池的说法正确的是
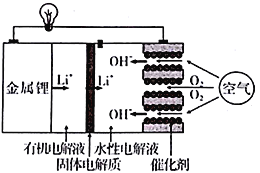
A. 有机电解液可以换成水性电解液
B. 放电时,外电路通过2 mol 电子,消耗氧气11.2 L
C. 放电和充电时,Li+迁移方向相同
D. 电池充电时,在正极上发生的反应为4OH--4e-= O2↑+2H2O
科目:高中化学 来源: 题型:
【题目】
有机物G用作有机合成的中间体等,合成G的一种路线如下。

已知:![]()
请回答下列问题;
(1)F的化学名称是________________,①的反应类型是_______________________。
(2)B中含有的官能团是_____________________________(写名称)。
(3)D聚合生成高分子化合物的化学方程式为___________________________________。
(4)反应③的化学方程式是___________________________________。
(5)芳香族化合物N是A的同分异构体,其中核磁共振氢谱为三组峰的结构简式为___________________________________。
(6)参照有机物G的上述合成路线,设计以M和一氯甲烷为起始原料制备F的合成路线(无机试剂任选) _____________________。
【示例:![]() 】
】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用0.1000 mol·L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O
填空完成问题:
(1)该滴定实验所需的玻璃仪器有______________。(填字母)
A.酸式滴定管B.碱式滴定管 C.量筒 D.锥形瓶 E.铁架台F.滴定管夹G.烧杯H.白纸 I.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因___________________________________________。
(3)滴定终点的现象为___________________________________。
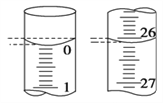
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol/L KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为_______________。
(6)下列操作中可能使测定结果偏低的是___________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下图两种化合物的结构或性质描述正确的是( )
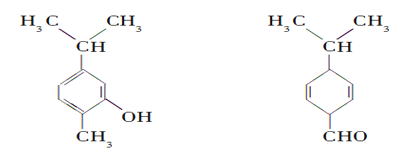
A. 不是同分异构体
B. 分子中共平面的碳原子数相同
C. 均能与溴水反应
D. 可用红外光谱区分,但不能用核磁共振氢谱区分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. Fe与稀硫酸反应:2Fe+6H+=Fe3++3H2↑
B. Cu与AgNO3溶液反应:Cu+2Ag+=Cu2++2Ag
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,其单质及化合物在航天、军事、航海、医疗等领域都有着重要的应用。请回答下列问题:
(1)基态Ti 原子的价层电子排布图为________________________。
(2)在TiO、TiN、TiS2、TiCl4等化合物中,S、Cl的电负性大小:S________Cl (填“>”、“<”或“=”)。O、N 的第一电离能大小为O < N,原因是___________________________。
(3)TiCl4的熔点是-23℃,沸点是136℃,可溶于CCl4,该晶体是_______ 晶体。TiCl4中加入大量水,同时加热,可制得二氧化钛的水合物(TiO2·xH2O),再经焙烧可得TiO2,写出生
成二氧化钛水合物(TiO2·xH2O)的化学方程式_________________________________。
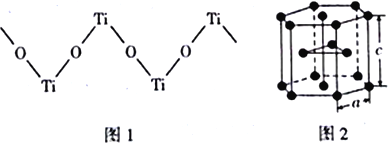
(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如下图1所示,其化学式为_____________。阴离子SO42-中硫原子的杂化方式为______________,写出一种与SO42-互为等电子体的分子_____________。
(5)下图2是钛晶体在空间的一种堆积方式,此堆积方式叫______________,钛原子的配位数为____________。已知:a=0.295 nm,c=0.469nm,则该钛晶体的密度为_________g·cm-3(NA表示阿伏加德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,22.4LH2O所含的分子数为NA
B.14g氮气所含的氮原子数为NA
C.标准状况下,22.4LNH3所含的电子数为NA
D.1molNa与Cl2反应转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为V L的密闭容器中发生化学反应CO(g)+2H2(g) ![]() CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是( )
CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是( )
A. v生成(CH3OH)=v消耗(CO) B. CO、H2、CH3OH的浓度比为1:2:1
C. 混合气体的密度不再改变 D. 混合气体的平均相对分子质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁发生电化腐蚀时,负极上发生的反应是( )
A.2H++2e-=H2↑B.2H2O+O2+4e-=4OH-
C.Fe-2e-=Fe2+D.4OH--4e-=O2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com