
【题目】下图是几种常见有机物之间的转化关系图。A为常见医用消毒药品,C具有浓郁香味。
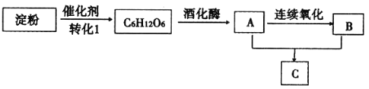
根据以上信息及各物质的转化关系,完成下列各题:
(1)A的结构简式为_____,写出工业上用乙烯生产A的化学方程式_________。
(2)B的官能团名称为______。
(3)A+B→C的化学方程式为______,反应类型为反应_______。
(4)下列说法正确的是_____
a.上图物质中只有C6H12O6属于糖类
b.转化1可在人体内完成
c.物质C属于油脂
d.物质A和B均为电解质
【答案】CH3CH2OH CH2=CH2+H2O![]() C2H5OH 羧基 CH3COOH+C2H5OH
C2H5OH 羧基 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 取代(或酯化) b
CH3COOC2H5+H2O 取代(或酯化) b
【解析】
淀粉经过水解得到葡萄糖C6H12O6,C6H12O6经过酒化酶的催化作用,反应生成A(CH3CH2OH),A再经过连续氧化得到B(CH3COOH),A、B反应得到C(CH3CH2OOCCH3)。
(1)经分析,A为CH3CH2OH,工业上用乙烯生产A的化学方程式为CH2=CH2+H2O![]() C2H5OH;
C2H5OH;
(2)B为CH3COOH,其官能团为羧基;
(3)A+B→C的化学方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,该反应为取代反应(酯化反应);
CH3COOC2H5+H2O,该反应为取代反应(酯化反应);
(4)a、淀粉和葡萄糖都属于糖类,a错误;
b、淀粉转化为葡萄糖可在人体中进行,b正确;
c、油脂是由甘油和高级脂肪酸形成的酯,C(CH3COOC2H5)由乙酸和乙醇反应制得,属于酯类,不属于油脂,c错误;
d、A(CH3CH2OH)为非电解质,B(CH3COOH)为弱电解质,d错误;
故选b。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.热的纯碱液去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污力增强
B.铁在潮湿的环境下生锈以及Mg与NH4Cl溶液反应生成H2都与盐类水解有关
C.将Al2(SO4)3溶液加热、蒸干、灼烧,可得到固体Al2(SO4)3
D.将饱和FeCl3溶液滴入沸水中制胶体,离子方程式:Fe3++3H2O![]() Fe(OH)3(胶体) +3H+
Fe(OH)3(胶体) +3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列几种物质:A.石墨和C60;B.35Cl和37Cl;C.CH3CH=CHCH3和(CH3)2C=CH2;D.![]() 和
和![]() ;E.间二甲苯和异丙苯,请把合适字母填入以下横线里:属于同分异构体的是____;属于同系物的是____;属于同种物质的是______。
;E.间二甲苯和异丙苯,请把合适字母填入以下横线里:属于同分异构体的是____;属于同系物的是____;属于同种物质的是______。
(2)Dieis-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的反应是: ![]() ,而
,而![]() 是由A(C5H6)和B经Dieis-Alder反应制得。写出A的结构简式:_______。
是由A(C5H6)和B经Dieis-Alder反应制得。写出A的结构简式:_______。
(3)如图是某药物中间体(仅含C、H、O三种元素)的结构示意图:
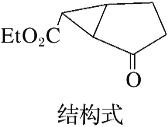
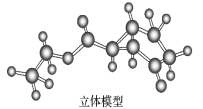
试回答下列问题:
①观察上面的键线式结构式与立体模型,通过对比指出结构式中的“Et”表示______(填名称);该药物中间体分子的化学式为______。
②现有一种芳香族化合物与该药物中间体互为同分异构体,其分子中共有三种不同类型的氢原子,试写出该化合物的结构简式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应A(g)+2B(g)![]() 2C(g),达到平衡状态的标志
2C(g),达到平衡状态的标志
A.A的分解速率和C的生成速率比为1:2
B.单位时间内生成n mol A的同时生成2n mol B
C.A、B的物质的量比为1:2
D.A、B、C的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯化反应是酸与醇发生反应生成酯和水的反应。下列反应属于酯化反应的是( )
A. CH3COOH+NaOH→CH3COONa+H2O
B. CH2==CHCOOCH3+H2![]() CH3CH2COOCH3
CH3CH2COOCH3
C. CH3COOCH2CH3+H2O![]() CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH
D. 2CH3COOH+HOCH2CH2OH![]() CH3COOCH2CH2OOCCH3+2H2O
CH3COOCH2CH2OOCCH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某镍矿(主要成分为NiS、CuS、FeS、SiO2等)为原料制备一种多孔结构的细小镍晶粒,可用作有机物氢化反应的催化剂和储氢材料。工艺流程如图所示:[已知金属活动顺序为:Fe>Ni>(H)>Cu]
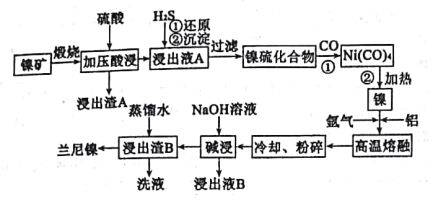
(1)已知该镍矿煅烧后生成Ni2O3,而加压酸浸液A中含有Ni2+,写出有关镍元素的加压酸浸的化学方程式___。
(2)已知Ni(CO)4的沸点是42.2℃,Ni(S)+4CO(g)![]() Ni(CO)4(g)的平衡常数与温度的关系如下:
Ni(CO)4(g)的平衡常数与温度的关系如下:

步骤①、步骤②的最佳温度分别是___、___(填选项代号)
A.25℃ B.30℃ C.50℃ D.80℃ E.230℃
(3)“高温熔融”时通入氩气的目的是___。
(4)“碱浸”是整个流程的核心步骤,该步骤的目的是___,发生反应的离子方程式为___。
(5)浸出液B可以回收,重新生成铝以便循环利用,请设计简单的回收流程:
(示例:![]() )浸出液B→___。
)浸出液B→___。
(6)镍硫化合物中会含有少量的CuS,也可以采用电解精炼的方法获得纯镍,流程为:
![]()
电解制粗镍时阳极发生的主要电极反应式为___;
精炼过程需控制pH2~5的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)高铁酸钠(Na2FeO4)可作为高效、多功能水处理剂,其摩尔质量是__________。高铁酸钠可与水反应生成Fe(OH)3胶体、氢氧化钠和氧气,写出相应的离子方程式:_____________。
(2)戴维通过电解法首先制得了金属钠,随后几十年内,工业上采用铁粉和氢氧化钠高温熔融的方法制得钠蒸气,同时获得Fe3O4和氢气。写出该反应的化学方程式_____________,该反应中属于电解质但不属于氧化物的物质是________________(填化学式),若制得22.4L(折算为标准状况下)钠蒸气,转移电子的数目为________________。
(3)漂白粉常用于饮水、污水、排泄物及被污染的环境消毒,其主要成分是氯化钙和次氯酸钙[Ca(ClO)2],有效成分为次氯酸钙。为测得某漂白粉的有效成分含量,称取A g漂白粉样品溶解,往所得溶液中通入CO2至不再产生沉淀为止,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,若反应生成次氯酸(HClO)的物质的量为Kmol,则该漂白粉中有效成分的质量分数为___________%(用含A、K的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.l mol硫酸钾中阴离子所带电荷数为NA
B.乙烯(C2H4)和环丙烷(C3H6)组成的28g混合气体中含有4NA个氢原子
C.22.4L氯气和足量氢气反应转移的电子数为2NA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.2NA个Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂基催化剂表面的氧化还原反应(ORR)是燃料电池最重要的阴极反应。厦门大学李剑锋课题组模拟研究了在酸性条件下铂单晶表面的反应路径如图所示,其中吸附在铂基催化剂表面上的物种用*标注。下列说法正确的是( )
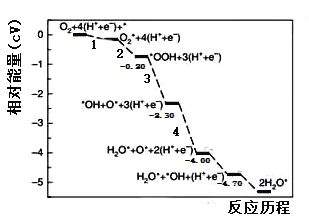
A.②为氧氧双键的断裂过程
B.过程③断裂非极性键,过程⑤形成非极性键
C.该历程的总反应式为O2+4H++4e-=2H2O
D.若在碱性条件下,铂单晶表面的ORR过程及产物均不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com