
【题目】3H2O2 + 2H2CrO4 = 2Cr(OH)3 + 3O2 ↑+ 2H2O
(1)其中Cr被___________,H2O2作____________剂。
(2)_____________是氧化产物,_______________发生还原反应。
(3)反应转移了0.3mol电子,则产生的气体在标准状态下体积约为__________。
(4)用单线桥或双线桥法标明电子转移的方向和数目。_____________
【答案】还原 还原 O2 H2CrO4 3.36L ![]()
【解析】
依据氧化还原反应中元素化合价的变化分析判断,元素化合价升高的做还原剂,被氧化,发生氧化反应,元素化合价降低的做氧化剂,被还原,发生还原反应,据此分析解答。
(1)3H2O2+2H2CrO4═2Cr(OH)3+3O2↑+2H2O,反应中氧元素化合价由-1价变化为0价,化合价升高,做还原剂,被氧化,发生氧化反应;铬元素化合价从-6价变化为+3价,化合价降低,做氧化剂,被还原,发生还原反应,故答案为:还原;还原;
(2)反应中O元素的化合价升高,则H2O2为还原剂被氧化,生成氧化产物为氧气,而Cr元素的化合价降低,被还原,发生还原反应,还原过程为H2CrO4→Cr(OH)3,故答案为:O2;H2CrO4;
(3)3H2O2+2H2CrO4═2Cr(OH)3+3O2↑+2H2O,依据元素化合价变化,生成3mol氧气转移电子6mol,因此反应转移0.3mol电子,则产生的气体为0.15mol,在标准状态下体积约为0.15×22.4L/mol=3.36L,故答案为:3.36L;
(4)Cr的化合价从+6→+3,得电子,O的化合价从-1→0,失电子,转移电子总数为2×(6-3)═6,用单线桥法表示反应中电子转移的方向和数目为:![]() ,故答案为:
,故答案为:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某硏究小组为硏究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。
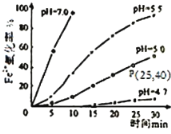
回答下列问题:
(1)写出Fe2+水解的离子方程式___;要抑制FeSO4水解,可以采取的措施是___。
(2)若配制的FeSO4溶液浓度为0.01mol/L,反应过程中溶液体积不变,计算图中P点Fe2+的氧化速率___。
(3)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O2+4H+![]() 4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是___。
4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是___。
a.Fe2+转化为Fe3+的趋势很大
b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全
d.酸性条件下Fe2+不会被氧化
(4)结合图分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响___。
(5)用K2Cr2O7标准溶液測定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O,若取20mL待测溶液,用0.0200mol·L1K2Cr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=___mol·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.4g某有机物M置于密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气。将燃烧产物依次通过浓硫酸、碱石灰和灼热的氧化铜(试剂均足量,且充分反应),测得浓硫酸增重1.44g,碱石灰增重1.76g,氧化铜减轻0.64g。下列说法中不正确的是
A. M的实验式为CH2O
B. 若要得到M的分子式,还需要测得M的相对分子质量或物质的量
C. 若M的相对分子质量为60,则M一定为乙酸
D. 通过红外光谱仪可分析M中的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国西部地区有丰富的盐湖资源,对盐湖矿产资源的综合开发利用是西部大开发的重要课题之一
.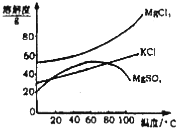
I.某研究性学习小组拟取盐湖苦卤的浓缩液![]() 富含
富含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等
等![]() ,来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
,来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
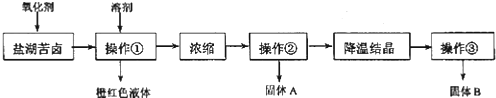
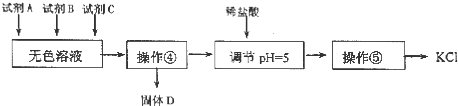
![]() 某同学提出了另一种新方案,对上述操作①后无色溶液进行除杂提纯,无色溶液中先加试剂A,再加试剂B,最后加试剂
某同学提出了另一种新方案,对上述操作①后无色溶液进行除杂提纯,无色溶液中先加试剂A,再加试剂B,最后加试剂![]() 常见的盐
常见的盐![]() ,其方案如下:
,其方案如下:
下列说法不正确的是
A.要从橙红色液体中分离出单质溴,可采取的操作是蒸馏
B.操作![]() 为过滤,主要目的是为了除去
为过滤,主要目的是为了除去![]()
C.试剂C为![]() ,固体D主要为
,固体D主要为![]() ,还有少量的
,还有少量的![]()
D.若在操作![]() 结束后发现溶液略有浑浊,应采取的措施是更换滤纸,重新过滤
结束后发现溶液略有浑浊,应采取的措施是更换滤纸,重新过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是____。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备实验:
①甲同学的操作是:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确____。
②乙同学直接加热饱和FeCl3溶液,请评价是否正确____。
③丙同学向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确__。
(3)写出制备Fe(OH)3胶体的化学方程式:_____。证明有Fe(OH)3胶体生成的实验操作是________。利用的胶体性质是___。
(4)Fe(OH)3胶体稳定存在的主要原因是___。
A.胶粒直径小于1 nm B.胶粒带正电荷
C.胶粒作布朗运动 D.胶粒能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)M与Q是同素异形体,由M=Q;△H = -19KJ/mol可知,M比Q________(填稳定、不稳定)。
(2)已知:![]()
![]()
请写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式_________________。
(3)在与外界隔离的体系中,自发过程将导致体系的熵__________,(填“增大”、“减小”、“不变”);对于同一种物质,________时熵值最大(填“固态”、“液态”、“气态”)。
(4)某工厂实验室用CO和H2制备CH3OH,其原理为:![]() 该温度下的化学平衡常数表达式__________________;若在298K、398K时化学平衡常数分别为K1、K2,则K1 ___ K2(填“>”、“<”、“=”)。
该温度下的化学平衡常数表达式__________________;若在298K、398K时化学平衡常数分别为K1、K2,则K1 ___ K2(填“>”、“<”、“=”)。
(5)500℃条件下,对于反应![]() ,K=2.33 ,测得某时刻,A(g)、B(g)、C(g)的浓度均为0.5mol/L,则此时v(正) ______ v(逆)(填“>”“<”或“=”)。
,K=2.33 ,测得某时刻,A(g)、B(g)、C(g)的浓度均为0.5mol/L,则此时v(正) ______ v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有![]() 和
和![]()
![]() 中的一种或多种。下列根据实验事实得出的结论正确的是
中的一种或多种。下列根据实验事实得出的结论正确的是
A.取一定量固体加热,若质量减少,说明原固体中一定含有![]()
B.取一定量固体,向其中加入稀盐酸,有气体生成,说明原固体中一定含有![]()
C.取一定量固体,溶解,向溶液中滴加适量![]() 溶液,观察到有白色沉淀生成,说明原固体中一定含有
溶液,观察到有白色沉淀生成,说明原固体中一定含有![]()
D.取一定量固体,溶解,向溶液中加入适量澄清石灰水,充分反应后观察到有白色沉淀生成,说明原固体中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下,下列分析不正确的是( )

A.“84消毒液”保存时不能敞口放置,需要密封保存
B.该“84消毒液”中NaClO的物质的量浓度约为4mol·L-1
C.取100mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04mol·L-1
D.欲用NaClO固体配制含25% NaClO的消毒液480mL,需要称量的NaClO固体质量为142.8g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com