

科目:高中化学 来源:不详 题型:单选题
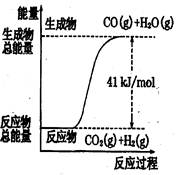
| A.CO+H2O=CO2+H2;△H="+41" kJ/mol |
| B.CO(g)+H2O(g)=CO2(g)+H2(g);;△H= ?41 kJ/mol |
| C.CO2(g)+H2(g)=CO(g)+H2O(g);△H="+41" kJ/mol |
| D.CO2(g)+H2(g) =CO(g)+H2O(g);△H=?41 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4Q1+0.5Q2 | B.4Q1+Q2+10Q3 | C.4Q1+2Q2 | D.4Q1+0.5Q2+9Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。
水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO(g)+6H2O(g); △H=-905 kJ/mol……①
4NO(g)+6H2O(g); △H=-905 kJ/mol……① 2N2(g)+6H2O(g);△H =-1268 kJ/mol……②,
2N2(g)+6H2O(g);△H =-1268 kJ/mol……②,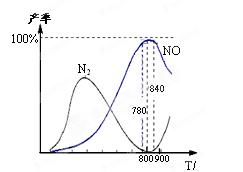
| A.工业上进行氨催化氧化生成 NO时,温度应控制在780~840℃之间 |
| B.工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率 |
| C.在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率 |
D.氮气氧化为NO的热化学方程式为:N2(g)+O2(g) 2NO(g) 2NO(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com