
【题目】有人设想合成具有以下结构的烃分子。
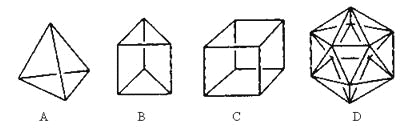
(1)结构D显然是不可能合成的,原因是________________________________;
(2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷的结构,写出金刚烷的分子式___________;
(3)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的化学键不是单双键交替排列的事实是______
a.它的对位二元取代物只有一种 b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相等 d.能发生取代反应和加成反应
(4)下列有关烃的说法正确的是_______
a.不符合通式CnH2n+2的烃都一定含不饱和键;
b.烃分子中H原子个数不一定都比C原子个数多;
c.若知道了某烃的C、H原子个数比,只能得出该烃的最简式,不可能得出分子式;
d.烃分子中H%最高的是甲烷。
【答案】C原子不能形成5个共价键 C10H16 bc bd
【解析】
(1)碳原子最外层只有4个电子,达到8电子稳定结构时最多可形成4个共价键,不能形成5个共价键,
故答案为碳原子不能形成5个共价键;
(2)根据结构可知最多可插入6个CH2原子团,则C应为10个,H应为6×2+4=16,所以分子式为C10H16;
(3)最简单的芳香烃应为苯,化学键不是单双键交替,分子中所有碳碳键的键长均相等,它的邻位二元取代物只有一种,可证明该结构特征,而无论是否单双键交替,它的对位二元取代物都只有一种,且在一定条件下都能发生取代反应和加成反应,所以证明的为bc,
故答案为bc;
(4)a.环烷烃通式为CnH2n,含饱和键,选项a错误;
b.烃分子中H原子个数不一定都比C原子个数多,如稠环芳香烃,选项b正确;
c.如为烷烃,碳原子化合价达到饱和,若知道了某烃的C、H原子个数比,可得出分子式,选项c错误;
d.甲烷的分子式为CH4,烃分子中H%最高的是甲烷,选项d正确。
故答案为bd。


科目:高中化学 来源: 题型:
【题目】某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。下列说法正确的是( )
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下达平衡后,增大压强平衡不移动
B.该反应方程式可表示为:X+2Y=3W
C.升高温度,若W的体积分数减小,则此反应ΔH>0
D.恒温恒容时,增加X的物质的量,平衡向正向移动,X的转化率提高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜生锈会生成铜绿[Cu2(OH)2CO3],铜绿受热易分解,化学方程式为:Cu2(OH)2CO3 ![]() 2CuO+H2O+CO2↑。
2CuO+H2O+CO2↑。
(1)部分锈蚀成铜绿的铜片隔绝空气加热,完全反应后固体质量减少了9.3g,则生锈的铜片中铜绿的质量为___________g
(2)将35g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液PH值为1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到39.2g蓝色固体。(假设反应前后溶液的体积不变)
①已锈蚀的铜片中的铜元素的质量分数为________。(保留两位小数)
②铜片中单质铜的物质的量为________mol。
(3)若生成NO2和NO混合气体共a L(S.P.T)。
①求a的取值范围(写出详细解答过程)________。
②求原硝酸的物质的量浓度(用含a的代数式表示,写出详细解答过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )
pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )
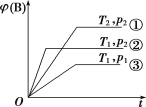
A.T1<T2,p1>p2,m+n>p,放热反应
B.T1<T2,p1>p2,m+n<p,吸热反应
C.T1>T2,p1<p2,m+n<p,吸热反应
D.T1>T2,p1<p2,m+n>p,放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型化学实验可以有效实现化学实验绿色化的要求。如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好。根据上述描述涉及到的元素,回答问题:
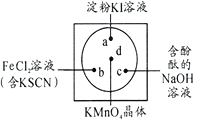
(1)KMnO4中Mn元素的化合价为:_______________,Fe在周期表中的位置是:_____________________。
(2)第三周期原子半径最小的原子共有______ 种不同能量的电子;长周期主族元素形成化合物的电子式为:__________________。
(3)结合已学知识分析a、c处的可能出现的现象:a:_____________________________;c:_________________________________;b处可能发生反应的离子方程式:___________________________________________________________
(4)已知溶液中,还原性为HSO3>I-,氧化性为IO3>I2>SO42.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示:
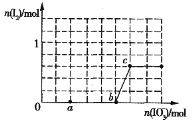
①a点处的还原产物是:____________(填离子符号); b点→c点反应的离子方程式是:_________________________________________
②当溶液中的I-为0.5mol时,加入的KIO3可能是:____________________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)抽烟对人体有害,烟草不完全燃烧产生的CO被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生反应:CO+HbO2![]() O2+HbCO。实验表明,HbCO的浓度即使只有HbO2浓度的2%,也足以使人的智力受损。试回答:
O2+HbCO。实验表明,HbCO的浓度即使只有HbO2浓度的2%,也足以使人的智力受损。试回答:
①上述反应的平衡常数表达式为K=_____________________。
②抽烟后,吸入肺部的空气中测得的CO和O2的浓度分别为10-6 mol·L-1和10-2 mol·L-1。已知37℃时,平衡常数K=220,这时HbCO的浓度__________HbO2浓度的0.02倍(填“大于”“等于”、或“小于”)。
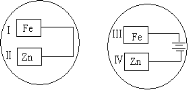
(2)把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。最先观察到酚酞变红的现象的区域是________和__________。(填序号“I”“II”“III”或“IV”)
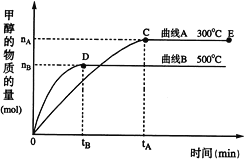
(3)一定条件下,在体积为3 L的密闭容器中,CO与H2反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K=___________,升高温度,K值 ________________。(填“增大”、“减小”或“不变”)。
②在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)=___________________。
③在其他条件不变的情况下,对处于E点的体系体积压缩到原来的![]() ,下列有关该体系的说法正确的是__________
,下列有关该体系的说法正确的是__________
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时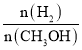 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳原子2p亚层上的2个电子不相同的方面是____(选填序号)。
a.能量 b.电子云形状 c.电子云伸展方向 d.自旋状态
14N 原子与12C原子比,质子数和中子数都更多,但原子半径却更小,请解释__________________。
(2)铍(Be)与铝性质相似。
①以下对铍及其化合物的推断肯定不正确的是______(选填序号)。
a.铍会在浓硫酸中钝化 b.氯化铍固体会发生升华现象
c.氧化铍坚硬难熔 d.铍的熔点低于镁
②写出BeCl2溶液和Na2BeO2溶液混合后反应的离子方程式____________________________。
(3)将BeCl2溶液加热蒸干后灼热,再使其熔融,用直流电电解,可得到单质铍和一种单质气体,则该气体的化学式为_______。
(4)氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:
2Al2O3(s)![]() 4Al(g)+3O2(g) ①
4Al(g)+3O2(g) ①
2C(s)+ O2(g)![]() 2CO(g) ②
2CO(g) ②
2Al(g)+N2(g)![]() 2AlN(s) ③
2AlN(s) ③
试分析反应②对制备AlN的作用______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是二十一世纪的“明星金属”。工业制钛以金红石为原料,发生的反应是:反应Ⅰ: aTiO2+bCl2+cC ![]() aTiCl4+cCO 反应Ⅱ:TiCl4+2Mg
aTiCl4+cCO 反应Ⅱ:TiCl4+2Mg![]() Ti+2MgCl2,关于反应Ⅰ、Ⅱ的下列说法中正确的是
Ti+2MgCl2,关于反应Ⅰ、Ⅱ的下列说法中正确的是
A.反应Ⅰ中的TiO2是氧化剂
B.TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂
C.a=b=c=2
D.每生成9.6 g Ti,反应Ⅰ、Ⅱ中共转移0.8 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛.将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O35H2O(大苏打).
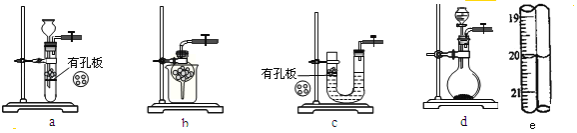
(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是_____(选填编号);检查该装置气密性的操作是:关闭止水夹,再_______________。
(2)在Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为________________(生成的盐为正盐);
②浅黄色沉淀保持一段时间不变,有无色无嗅的气体产生,则反应的化学方程式为__________________(生成的盐为正盐);
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为_______________(生成的盐为酸式盐)。
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为_________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是_________。
(4)硫代硫酸钠的纯度可用滴定法进行测定,原理是:2S2O32﹣+I3﹣=S4O62﹣+3I﹣.
①为保证不变质,配制硫代硫酸钠溶液须用新煮沸并冷却的蒸馏水,其理由是___________。
②取2.500g含杂质的Na2S2O35H2O晶体配成50mL溶液,每次取10.00mL用0.0500mol/L KI3溶液滴定(以淀粉为指示剂),实验数据如下(第3次初读数为0.00,终点读数如图e;杂质不参加反应):
编号 | 1 | 2 | 3 |
消耗KI3溶液的体积/mL | 19.98 | 20.02 |
到达滴定终点的现象是_______________;Na2S2O35H2O(式量248)的质量分数是(保留4位小数)__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com