
����Ŀ��(1)̼ԭ��2p�Dz��ϵ�2�����Ӳ���ͬ�ķ�����____��ѡ����ţ���
a������ b����������״ c����������չ���� d������״̬
14N ԭ����12Cԭ�ӱȣ��������������������࣬��ԭ�Ӱ뾶ȴ��С�������__________________��
(2)��(Be)�����������ơ�
�����¶��뼰�仯������ƶϿ϶�����ȷ����______��ѡ����ţ���
a�������Ũ�����жۻ� b���Ȼ������ᷢ����������
c���������Ӳ���� d������۵����þ
��д��BeCl2��Һ��Na2BeO2��Һ��Ϻ�Ӧ�����ӷ���ʽ____________________________��
(3)��BeCl2��Һ�������ɺ����ȣ���ʹ�����ڣ���ֱ�����⣬�ɵõ��������һ�ֵ������壬�������Ļ�ѧʽΪ_______��
(4)������(AlN)�㷺Ӧ���ڼ��ɵ�·�����Ʊ�ԭ���ǽ���������̼�ۻ�Ͼ��ȣ��ڳ��������ĵ������м�����1750�棬�������·�Ӧ��
2Al2O3(s)![]() 4Al(g)+3O2(g) ��
4Al(g)+3O2(g) ��
2C(s)+ O2(g)![]() 2CO(g) ��
2CO(g) ��
2Al(g)+N2(g)![]() 2AlN(s) ��
2AlN(s) ��
�Է�����Ӧ�ڶ��Ʊ�AlN������______________________________________________��
���𰸡�c ��ԭ���У����Ӻ�����ռ���������С�����Ӳ�����ͬʱ���˵����Խ�˶������ӵ�����Խ��ԭ�Ӱ뾶ԽС d Be2++ BeO22-+2H2O ![]() 2Be(OH)2�� O2 ����O2��ʹ�ٵ�ƽ�����ƣ��ٵ�ƽ����������������������Ũ�ȣ�ʹ��ƽ���������������Ʊ�AlN
2Be(OH)2�� O2 ����O2��ʹ�ٵ�ƽ�����ƣ��ٵ�ƽ����������������������Ũ�ȣ�ʹ��ƽ���������������Ʊ�AlN
��������
(1)̼ԭ��2p�Dz��ϵ�2�������Ų��ڲ�ͬ�Ĺ���ϣ���������״̬��ͬ��
14N ԭ����12Cԭ�ӱȣ��������������������࣬��ԭ�Ӱ뾶ȴ��С����ԭ�Ӻ˶������ӵ�������������
(2)��a��������Ũ�����жۻ�
b���Ȼ�������ᷢ����������
c����������Ӳ����
d�������۵����þ
��BeCl2��Һ��Na2BeO2��Һ��Ϻ���˫ˮ�ⷴӦ������Be(OH)2������
(3)��BeCl2��Һ�������ɺ����ȣ����õ�BeO���ɴ˿ɵ����ڵ�����õ�������Ļ�ѧʽ��
(4)�Ʊ�AlN���Ʊ�Al���ǿ��淴Ӧ���ӷ�Ӧ�ڶԷ�Ӧ�٢۵Ĵٽ����ý��з�����
(1)̼ԭ��2p�Dz��ϵ�2�������Ų��ڲ�ͬ�Ĺ���ϣ���������״̬��ͬ��������չ����ͬ����ѡc����Ϊ��c��
14N ԭ����12Cԭ�ӱȣ��������������������࣬��ԭ�Ӱ뾶ȴ��С����������ԭ���У����Ӻ�����ռ���������С�����Ӳ�����ͬʱ���˵����Խ�˶������ӵ�����Խ��ԭ�Ӱ뾶ԽС����Ϊ����ԭ���У����Ӻ�����ռ���������С�����Ӳ�����ͬʱ���˵����Խ�˶������ӵ�����Խ��ԭ�Ӱ뾶ԽС��
(2)��a��������Ũ�����жۻ���������Ũ������Ҳ���ܶۻ���a������ȷ��
b���Ȼ�������ᷢ�������������Ȼ������Ҳ���ܷ���������b������ȷ��
c����������Ӳ���ۣ�������Ҳ���ܼ�Ӳ���ۣ�c������ȷ��
d�������۵����þ������۵�Ҳ���ܸ�����(Be2+�뾶��Mg2+С�����������ͬ���γɽ������壬����������)��d�϶�����ȷ��
�Ӷ��ó������뼰�仯������ƶϿ϶�����ȷ����d����Ϊ��d��
��BeCl2��Һ��Na2BeO2��Һ��Ϻ���˫ˮ�ⷴӦ������Be(OH)2��������Ӧ�����ӷ���ʽΪ��Be2++ BeO22-+2H2O ![]() 2Be(OH)2������Ϊ��Be2++ BeO22-+2H2O
2Be(OH)2��������Be2++ BeO22-+2H2O ![]() 2Be(OH)2����
2Be(OH)2����
(3)��BeCl2��Һ�������ɺ����ȣ����õ�BeO���ɴ˿ɵ����ڵ�⣬����Be�����������õ�������Ļ�ѧʽΪO2����Ϊ��O2��
(4)�Ʊ�AlN���Ʊ�Al���ǿ��淴Ӧ����Ӧ�����ķ�Ӧ�����ɵ�O2���Ӷ������ڢ٢۷�Ӧ�Ľ��У��Ӷ��ó����Ʊ�AlN������������O2��ʹ�ٵ�ƽ�����ƣ��ٵ�ƽ����������������������Ũ�ȣ�ʹ��ƽ���������������Ʊ�AlN����Ϊ������O2��ʹ�ٵ�ƽ�����ƣ��ٵ�ƽ����������������������Ũ�ȣ�ʹ��ƽ���������������Ʊ�AlN��


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС��Ϊ�ϳ�![]() �������ϵ�֪һ���ϳ�·�ߣ�
�������ϵ�֪һ���ϳ�·�ߣ�

ԭ����CO���Ʊ�ԭ����HCOOH![]() CO����H2O������Ƴ�ԭ�������Ʊ�װ��(��ͼ)��
CO����H2O������Ƴ�ԭ�������Ʊ�װ��(��ͼ)��
����ʾ������(HCOOH��ͨ����һ����ɫ�ӷ���Һ�壬����Ũ�����������ֽ⣩
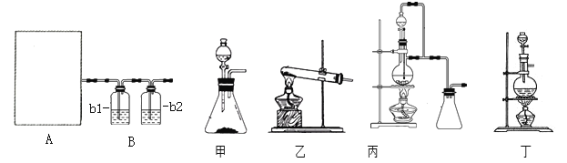
������������⣺
(1)ͼA�����ü�����ȡCO�ķ���װ�ã�����ʵ��ԭ����Ӧѡ��ͼ_____��������������������������������������ѡ���������______________________��
(2)��������װ���Ʊ����﴿����CO��b1��b2��ʢװ���Լ��ֱ���____________��_____��
(3)CO�����Ժͱ�ϩ��������ȡ������������ʽ���£�
CH3CH=CH2��CO��H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() CH3CH2CH2CH2OH��
CH3CH2CH2CH2OH��
����ȡԭ�ϱ�ϩʱ�����������SO2��CO2��ˮ������ijС���������Լ��������������壬�������ͨ���Լ���˳����_______(�����)��
��2%Ʒ����Һ ����ˮ ��ʯ��ˮ ����ˮCuSO4 �ݱ���Na2SO3��Һ
(4)����![]() ����������������ױ���Ϊ����ȡ�ϴ����IJ����С����������л�����������ʽ����˲��ģ��������£�
����������������ױ���Ϊ����ȡ�ϴ����IJ����С����������л�����������ʽ����˲��ģ��������£�
�ױ�����ɫ��Һ�壬�ܶ�0.87���е㣺110.6�棬������ˮ���ɻ����ڱ��ȶ����л��ܼ�����ɫ��ɫ��Һ�壬�ܶ�1.015���е�204-205�棬����ˮ�������ڴ����ѡ�ͨ����Щ���ϣ���С�������ijЩ���������в�����ᴿ����������_________��
A ��Һ B���� C���� D���ױ������ɱ������ٽ��з�Һ
(5)�õ��ϴ����IJ���֮��ijλͬѧΪ���о�����Ļ�ѧ���ʣ�������ͼױ��ֱ�ȡ�������ֱ�μ���ˮ��������ˮ���ն���ɫ�ˣ����ǵó����ۣ�����ͼױ��Ļ�ѧ�������ơ���λͬѧ�Ľ����Ƿ���ȷ��������ȷ����˵�����ɡ�_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڳ����µ���Һ��������ȷ����( )
A.ij��ˮ��Һ��pH��a��������Һϡ��10������Һ��pH��b����a��b
B.��1mL pH=1��������100mLNaOH��Һ��Ϻ���Һ��pH=7����NaOH��Һ��pH=11
C.�ڵ��з�̪��Һ�İ�ˮ�����������ǡ�ó���ɫ�����ʱ��Һ��pH��7
D.1.0��10-6mol/L�����pH=6��1.0��10-8mol/L�����pH=8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ϳɾ������½ṹ�������ӡ�
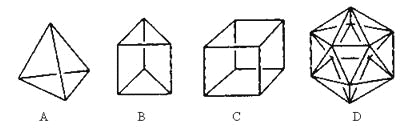
��1���ṹD��Ȼ�Dz����ܺϳɵģ�ԭ����________________________________��
��2���ڽṹA��ÿ����̼ԭ��֮�����һ��CH2ԭ���ţ������γɽ����Ľṹ��д�������ķ���ʽ___________��
��3��B��һ��ͬ���칹������ķ���������֤���÷������еĻ�ѧ�����ǵ�˫���������е���ʵ��______
a�����Ķ�λ��Ԫȡ����ֻ��һ�� b��������λ��Ԫȡ����ֻ��һ��
c������������̼̼���ļ�������� d���ܷ���ȡ����Ӧ�ͼӳɷ�Ӧ
��4�������й�����˵����ȷ����_______
a��������ͨʽCnH2n+2������һ���������ͼ���
b����������Hԭ�Ӹ�����һ������Cԭ�Ӹ����ࣻ
c����֪����ij����C��Hԭ�Ӹ����ȣ�ֻ�ܵó����������ʽ�������ܵó�����ʽ��
d����������H%��ߵ��Ǽ��顣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һNa2SO3�����ֱ����������ʡ�Ϊ�ⶨ��Ʒ���ȣ��ס�����λͬѧ�ֱ����������ʵ�鷽����
����ͬѧ����ȡm g��Ʒ����ˮ�����������BaCl2��Һ�����ˣ�������м���������ᣬ�ٹ��ˣ�����������ϴ�Ӻ���к�ɣ���ȴ��Ƶ�����Ϊm1 g��
(1)BaCl2��Һ���������ԭ����___________________________________________������Һ�еμ�____________��Һ����û�а�ɫ�������ɣ���֤��BaCl2��Һ���㣬�����������Һ�м���BaCl2��Һ����й��ˡ�ϴ�Ӳ�������ķ�����__________________________________________________����ϴ��Һ�еμ�_______________��Һ�������жϲ��������Ƿ�ϴ�Ӹɾ���
(2)�жϲ�����������m1 g�ܹ���Ϊʵ��ⶨֵ�������ʽ��������Ʒ���ȣ����벹���ʵ�������_________________________________________________________��
����ͬѧ����ȡm g��Ʒ����ˮ�������Һ���õζ���ȡV mL����ƿ�У���Ũ��Ϊc mol/L�ı����Ը��������Һ�ζ����յ㡣��Ӧ��ϵΪ��SO32�� + MnO4�� SO42�� + Mn2+ (δ��ƽ)
(3)������Ʒ��Һʱ����һ����Ҫ��ʵ��������__________(ѡ��𰸱��)��
a������ƿ b�������� c���ζ��� d���ձ�
(4)�ζ��յ���ж�������___________________________________________________��
(5)�����ζ��У��ζ�����ע�����Ը��������Һ֮ǰ����������ˮϴ��������__________________________________________���ζ���Һ��仯��ͼ��ʾ����ͼ��ͼ����ʾ���ĵĸ��������Һ���Ϊ__________________��
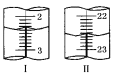
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��Br����ˮ����ȡBr2�Ĺ��̰��������ˡ���������ȡ����ѡ�������ȡ����������Ȳ��衣��֪��
���� | Br2 | CCl4 | ��ʮ���� |
�ܶ�/g��cm-3 | 3.119 | 1.595 | 0.753 |
�е�/�� | 58.76 | 76.8 | 215~217 |
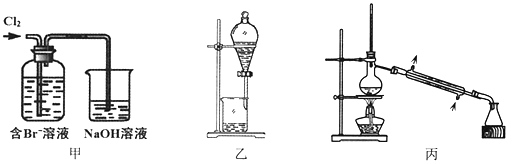
����˵������ȷ����
A. ��װ����Br�������ķ�ӦΪ��2Br-+ Cl2 = Br2 + 2Cl-
B. ��װ����NaOH��Һÿ����0.1mol Cl2��ת��0.1mol e��
C. ����װ�ý�����ȡ���ܽ�Br2���л������²�
D. �ñ�װ�ý����������ռ�������Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ʯ����Fe2O3��ת��Ϊ�Ȼ���ˮ���ﴢ�Ȳ��Ϻߴ��ȵ�̼��ƣ����۴Ӿ���Ч�滹����Դ�ۺ����ö�������Ҫ���塣�乤������ʾ��ͼ���¡�
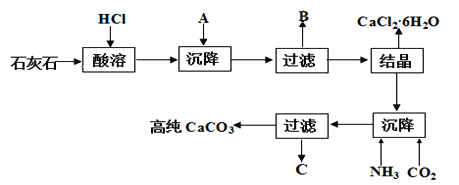
���������գ�
��1������������A��_________���ѧʽ����ͬ����д��B�еijɷ�___________��
��2��C���������ʣ�д������C�к���NH4+�ķ�����________��
��3���Ȼ��ƽᾧˮ���CaCl2��6H2O����Ŀǰ���õ������Ȳ��ϣ�ѡ���������_____��
a ��
b �ܵ���
c ������ˮ
d �۵�ϵͣ�29���ۻ���
![]() CaCl2��6H2O
CaCl2��6H2O
��4���������ط�����ã�CaCl2��6H2O�ڱ��չ����У����������ļ���ֵ�������꣩���¶ȱ仯��������ͼ��ʾ�����һ������ȶ������ʵĻ�ѧʽ��______��
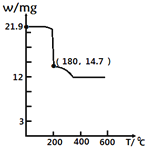
a CaCl2��4H2O
b CaCl2��2H2O
c CaCl2��H2O
d CaCl2
��5����ҵ���������ð����ĸҺ�����Ȼ��ơ�������ͼ�ܽ�����ߣ���ƴӺ�CaCl241%�ı���ʳ��ˮ�У�����Ȼ���ˮ���������______��
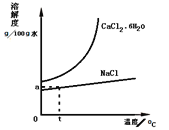
������ʾ�⣺![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ij������ȤС����ʵ�鷽������̽����
(1)ȡ�����ʵ���Ũ�ȡ��������H2O2��Һ�ֱ����H2O2�ķֽ�ʵ�飬ʵ�鱨�����±���ʾ������ͽ����ԣ���

��ʵ��1��2�о�����__________��H2O2�ֽ����ʵ�Ӱ�졣
��ʵ��2��3��Ŀ����_______________��H2O2�ֽ����ʵ�Ӱ�졣
(2)������֪��Cu2����H2O2�ֽ�Ҳ�д����ã�Ϊ�Ƚ�Fe3����Cu2����H2O2�ֽ�Ĵ�Ч������С���ͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�顣�ش�������⣺

�ٶ�����ͼ��ͨ���۲�_______�����ԱȽϵó����ۡ���ͬѧ�����CuSO4��Һ��ΪCuCl2��Һ����������������_________��
�ڶ�����ͼ����ʾ��ʵ��ʱ���ռ���40 mL����Ϊ��������������Ӱ��ʵ������أ�ʵ������Ҫ������������__________��
(3)���Ը��������Һ�Ͳ�����Һ�ɷ�����Ӧ��2KMnO4��5H2C2O4��3H2SO4=K2SO4��2MnSO4��8H2O��10CO2����ʵ��ʱ���ֿ�ʼ��Ӧ���ʽ�������Һ��ɫ�����ԣ���һ��ʱ���ͻȻ��ɫ����Ӧ�������Լӿ졣�Դ�չ�����ۣ�
��ijͬѧ��ΪKMnO4��H2C2O4�ķ�Ӧ��______�ȷ�Ӧ������_______________��
�ڴ�Ӱ�컯ѧ��Ӧ���ʵ����ؿ�������Ϊ��������________��Ӱ�졣Ҫ֤����IJ��룬ʵ�鷽����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2���ǻ��춡������������ˮ����һ��Ӧ�����л��ϳɺ�ҩ������Ļ���ԭ�ϡ�

��1��2���ǻ��춡�������ķ���ʽΪ_________����ͬ��ѧ���������ں˴Ź�������ͼ���в�ͬ�����շ壬��2���ǻ��춡��������_________�����շ壻
��2���٢ڵķ�Ӧ���ͷֱ�Ϊ_________��_________��
��3����֪IΪ�������I��B�Ļ�ѧ����ʽΪ_________��
��4�����۲���F�Ľṹ��ʽΪ_________��
��5�������![]() ��
�� ��˵����ȷ����_________��˫ѡ������ĸ����
��˵����ȷ����_________��˫ѡ������ĸ����
A����������FeCl3��Һ����ɫ����ǰ�߲���
B�����߶�������NaHCO3��Һ��Ӧ�ų�CO2
C�����߶�����������������Һ������Ӧ�����������ʵ������ʱ�������������Ƶ��������
D�����߶����������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com