
【题目】某大理石(含Fe2O3)转化为氯化钙水合物储热材料和高纯度的碳酸钙,无论从经济效益还是资源综合利用都具有重要意义。其工艺流程示意图如下。
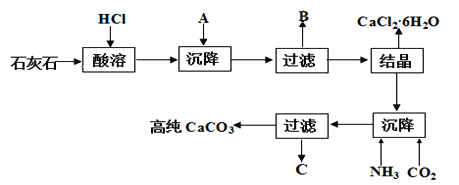
完成下列填空:
(1)上述流程中A是_________(填化学式,下同)、写出B中的成分___________。
(2)C可以作化肥,写出检验C中含有NH4+的方法:________。
(3)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是_____。
a 无毒
b 能导电
c 易溶于水
d 熔点较低(29℃熔化)
![]() CaCl2·6H2O
CaCl2·6H2O
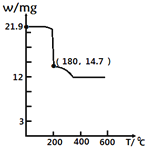
(4)经过热重分析测得:CaCl2·6H2O在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示。则第一个相对稳定的物质的化学式是______。
a CaCl2·4H2O
b CaCl2·2H2O
c CaCl2·H2O
d CaCl2
(5)工业还可以利用氨碱法的母液生产氯化钙。根据如图溶解度曲线,设计从含CaCl241%的饱和食盐水中,获得氯化钙水合物的流程______。
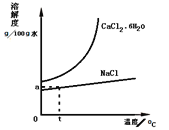
(流程示意:![]() )
)
【答案】CaCO3 CaCO3、Fe(OH)3 取滤液于洁净试管中,滴入浓氢氧化钠溶液,加热,试管口用湿润的红色石蕊试纸检验,变蓝,则证明含有铵根离子 a,d b ![]()
【解析】
石灰石的主要成分为碳酸钙,含有Fe2O3杂质,可先加入盐酸溶解,然后加入碳酸钙,使铁离子水解生成氢氧化铁沉淀,过滤得到的滤渣为碳酸钙和氢氧化铁混合物,滤液为氯化钙溶液,结晶可得到CaCl26H2O,在沉降后的母液中通入氨气、二氧化碳,可得到碳酸钙沉淀,滤液C为氯化铵;加热到180℃时固体的质量由21.9g变为14.7g,失去部分结晶水,根据氯化钙和水的物质的量确定化学式;从含CaCl241%的饱和食盐水中,获得氯化钙水合物,由图象可以知道氯化钙的溶解度随温度升高变化较大,可蒸发结晶,趁热过滤除去氯化钠,然后冷却结晶可得到氯化钙晶体,过滤分离。据此分析。
(1)石灰石的主要成分为碳酸钙,含有Fe2O3杂质,可先加入盐酸溶解,然后加入碳酸钙,使铁离子水解生成氢氧化铁沉淀,过滤得到的滤渣为碳酸钙和氢氧化铁混合物,滤液为氯化钙溶液,结晶可得到CaCl26H2O,在沉降后的母液中通入氨气、二氧化碳,可得到碳酸钙沉淀,滤液C为氯化铵,由以上分析可以知道A为CaCO3,B为CaCO3和Fe(OH)3,答案是:CaCO3;CaCO3和Fe(OH)3;
(2)检验铵根离子,可加入浓氢氧化钠溶液,然后加热生成氨气,因氨气水溶液呈碱性,则可用湿润的红色石蕊试纸检验,变红,说明含有铵根离子;答案是:取滤液于洁净试管中,滴入浓氢氧化钠溶液,加热,试管口用湿润的红色石蕊试纸检验,变蓝,则证明含有铵根离子;
(3)氯化钙结晶水合物(CaCl26H2O)是目前常用的无机储热材料,主要是利用无毒,熔点较低的性质,与导电性、溶解性无关;答案是:a,d;
(4)21.9gCaCl26H2O物质的量为0.1mol,m(CaCl2)=0.1mol×111g∕mol=11.1g,加热到180℃时固体的质量由21.9g变为14.7g,失去部分结晶水,则14.7g固体中含水的物质的量为:![]() ,则n(CaCl2):n(H2O)=0.1mol:0.2mol=1:2,则分子式为CaCl22H2O;答案是:b;
,则n(CaCl2):n(H2O)=0.1mol:0.2mol=1:2,则分子式为CaCl22H2O;答案是:b;
(5)从含CaCl241%的饱和食盐水中,获得氯化钙水合物,由图象可以知道氯化钙的溶解度随温度升高变化较大,可蒸发结晶,趁热过滤除去氯化钠,然后冷却结晶可得到氯化钙晶体,过滤分离,流程为![]() ;
;
答案是:![]()


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,某烃分子的相对分子量为28,一定体积的该烃完全燃烧生成4.48LCO2和3.6g水,该烃的分子式_________________。
(2)顺-1,2-二溴乙烯结构式_________________。
(3)2-丁烯与HCl的加成方程式_______________________________________。
(4)![]() 的系统命名为________________。
的系统命名为________________。
(5)按要求回答下列问题:
合成芳香炔化合物的方法之一是在催化条件下,含炔氢的分子与溴苯发生反应,如:
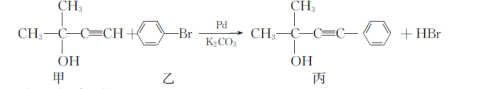
根据上式,请回答:
①丙能发生的反应是__________ (选填字母)。
a.取代反应 b.加成反应 c.水解反应 d.消去反应
②甲中含有的官能团名称为__________。
③符合下列条件的丙的同分异构体有__________种(不包括顺反异构)。
a分子中除苯环外不含其他环状结构;
b苯环上只有2个取代基,且其中一个是醛基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型化学实验可以有效实现化学实验绿色化的要求。如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好。根据上述描述涉及到的元素,回答问题:
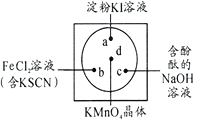
(1)KMnO4中Mn元素的化合价为:_______________,Fe在周期表中的位置是:_____________________。
(2)第三周期原子半径最小的原子共有______ 种不同能量的电子;长周期主族元素形成化合物的电子式为:__________________。
(3)结合已学知识分析a、c处的可能出现的现象:a:_____________________________;c:_________________________________;b处可能发生反应的离子方程式:___________________________________________________________
(4)已知溶液中,还原性为HSO3>I-,氧化性为IO3>I2>SO42.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示:
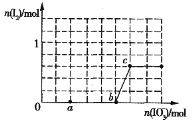
①a点处的还原产物是:____________(填离子符号); b点→c点反应的离子方程式是:_________________________________________
②当溶液中的I-为0.5mol时,加入的KIO3可能是:____________________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳原子2p亚层上的2个电子不相同的方面是____(选填序号)。
a.能量 b.电子云形状 c.电子云伸展方向 d.自旋状态
14N 原子与12C原子比,质子数和中子数都更多,但原子半径却更小,请解释__________________。
(2)铍(Be)与铝性质相似。
①以下对铍及其化合物的推断肯定不正确的是______(选填序号)。
a.铍会在浓硫酸中钝化 b.氯化铍固体会发生升华现象
c.氧化铍坚硬难熔 d.铍的熔点低于镁
②写出BeCl2溶液和Na2BeO2溶液混合后反应的离子方程式____________________________。
(3)将BeCl2溶液加热蒸干后灼热,再使其熔融,用直流电电解,可得到单质铍和一种单质气体,则该气体的化学式为_______。
(4)氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:
2Al2O3(s)![]() 4Al(g)+3O2(g) ①
4Al(g)+3O2(g) ①
2C(s)+ O2(g)![]() 2CO(g) ②
2CO(g) ②
2Al(g)+N2(g)![]() 2AlN(s) ③
2AlN(s) ③
试分析反应②对制备AlN的作用______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸的一种合成路线如下:
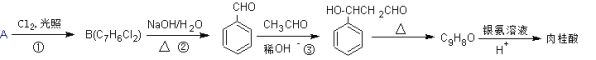
(1)烃A的名称为_________。反应①中B的产率偏低,其原因是________________________。
(2)反应②的化学方程式为_________________________________________________。
(3)反应③的反应类型是________________。
(4)肉桂酸的结构简式为__________________。
(5)反应③的产物同分异构体有多种,其中苯环上直接有一个甲基的酯类化合物有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是二十一世纪的“明星金属”。工业制钛以金红石为原料,发生的反应是:反应Ⅰ: aTiO2+bCl2+cC ![]() aTiCl4+cCO 反应Ⅱ:TiCl4+2Mg
aTiCl4+cCO 反应Ⅱ:TiCl4+2Mg![]() Ti+2MgCl2,关于反应Ⅰ、Ⅱ的下列说法中正确的是
Ti+2MgCl2,关于反应Ⅰ、Ⅱ的下列说法中正确的是
A.反应Ⅰ中的TiO2是氧化剂
B.TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂
C.a=b=c=2
D.每生成9.6 g Ti,反应Ⅰ、Ⅱ中共转移0.8 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糕点包装中常见的脱氧剂组成:还原性铁粉、氯化钠、炭粉等。脱氧过程中
A.发生析氢腐蚀
B.铁粉作阴极发生氧化反应
C.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
D.可以吸热,从而降低温度,起保鲜糕点的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A.1mol![]() 参加反应,转移2mol电子
参加反应,转移2mol电子
B.![]() 在反应中被氧化
在反应中被氧化
C.![]() 的还原性强于ClO2
的还原性强于ClO2
D.CO2是![]() 被氧化后得到的产物
被氧化后得到的产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com