
【题目】肉桂酸的一种合成路线如下:
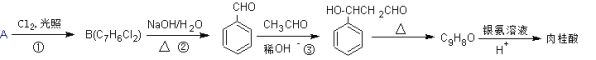
(1)烃A的名称为_________。反应①中B的产率偏低,其原因是________________________。
(2)反应②的化学方程式为_________________________________________________。
(3)反应③的反应类型是________________。
(4)肉桂酸的结构简式为__________________。
(5)反应③的产物同分异构体有多种,其中苯环上直接有一个甲基的酯类化合物有_____种。
【答案】甲苯 有一氯取代物和三氯取代物生成 ![]() +2NaOH
+2NaOH![]()
![]() +2NaCl+H2O 加成反应
+2NaCl+H2O 加成反应 ![]() 9
9
【解析】
由![]() 可推出A的结构简式为
可推出A的结构简式为![]() ,B的结构简式为
,B的结构简式为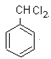 ,由分子式C9H8O,结合前一物质的结构简式,可确定其结构简式为
,由分子式C9H8O,结合前一物质的结构简式,可确定其结构简式为![]() ,从而得出肉桂酸的结构简式为
,从而得出肉桂酸的结构简式为![]() 。
。
(1)烃A的结构简式为![]() ,则其名称为甲苯。反应①中,可能生成B,也可能生成一氯代物、三氯代物等,所以产率偏低,其原因是有一氯取代物和三氯取代物生成。答案为:甲苯;有一氯取代物和三氯取代物生成;
,则其名称为甲苯。反应①中,可能生成B,也可能生成一氯代物、三氯代物等,所以产率偏低,其原因是有一氯取代物和三氯取代物生成。答案为:甲苯;有一氯取代物和三氯取代物生成;
(2)反应②中,![]() 在碱性条件下发生水解反应
在碱性条件下发生水解反应![]() ,反应的化学方程式为
,反应的化学方程式为![]() +2NaOH
+2NaOH![]()
![]() +2NaCl+H2O 。答案为:
+2NaCl+H2O 。答案为:![]() +2NaOH
+2NaOH![]()
![]() +2NaCl+H2O ;
+2NaCl+H2O ;
(3)反应③是![]() 与CH3CHO发生反应生成
与CH3CHO发生反应生成![]() ,反应类型是加成反应。答案为:加成反应;
,反应类型是加成反应。答案为:加成反应;
(4)由前面推断得出,肉桂酸的结构简式为![]() 。答案为:
。答案为:![]() ;
;
(5)反应③的产物同分异构体有多种,其中苯环上直接有一个甲基的酯类化合物,取代基有-CH3和-CH2OOCH、-CH3和-OOCCH3、-CH3和-COOCH3三种形式,且苯环上的两个取代基可分别处于邻、间、对三个位置,所以符合条件的同分异构体共有9种。答案为:9。


科目:高中化学 来源: 题型:
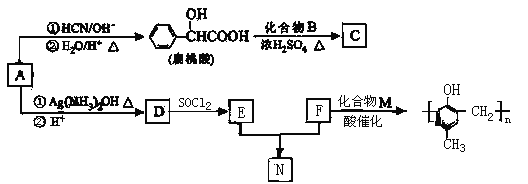
【题目】镇痉药物C、化合物N以及高分子树脂 的合成路线如下:
的合成路线如下:
已知:RCHO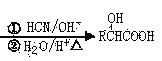
RCOOH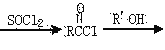 RCOOR’
RCOOR’
(1)扁桃酸(![]() )有多种同分异构体,写出任意一种属于甲酸酯且含有亚甲基
)有多种同分异构体,写出任意一种属于甲酸酯且含有亚甲基![]() ,并且苯环上的一氯代物有两种的同分异构体的结构简式__________。
,并且苯环上的一氯代物有两种的同分异构体的结构简式__________。
(2)化合物M中官能团的名称是______,F和化合物M反应生成高分子树脂![]() 的反应类型是_____________。
的反应类型是_____________。
(3)酯类化合物C的分子式是C15H14O3 ,A在催化剂作用下可与H2 反应生成B,则扁桃酸和化合物B反应生成C的化学方程式为________________。
(4)N在NaOH溶液中发生水解反应的化学方程式是_____________。
(5)请写出由A的同系物制备比 ![]() 少2个氢原子芳香烃的合成路线。(无机物试剂任选)____________
少2个氢原子芳香烃的合成路线。(无机物试剂任选)____________
合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应,在t1时达到平衡:A(g)+ B(g)![]() xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是
xC(g)+D(s)。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。有关说法正确的是
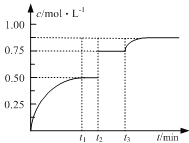
A.反应方程式中x=2
B.t2时刻改变的条件是使用催化剂
C.t3时刻改变的条件是移去少量D
D.t1~t3间该反应的平衡常数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一Na2SO3固体因部分被氧化而变质。为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:
(甲同学)称取m g样品溶于水,加入过量的BaCl2溶液。过滤,向沉淀中加入过量盐酸,再过滤,将残留固体洗涤后进行烘干,冷却后称得质量为m1 g。
(1)BaCl2溶液必须过量的原因是___________________________________________。在滤液中滴加____________溶液,若没有白色沉淀生成,则证明BaCl2溶液不足,还需继续在滤液中加入BaCl2溶液后进行过滤。洗涤残留固体的方法是__________________________________________________;在洗出液中滴加_______________溶液,可以判断残留固体是否洗涤干净。
(2)判断残留固体质量m1 g能够作为实验测定值代入计算式,推算样品纯度,必须补充的实验操作是_________________________________________________________。
(乙同学)称取m g样品溶于水,配成溶液,用滴定管取V mL于锥形瓶中,用浓度为c mol/L的标准酸性高锰酸钾溶液滴定至终点。反应关系为:SO32- + MnO4- SO42- + Mn2+ (未配平)
(3)配制样品溶液时,不一定需要的实验仪器是__________(选填答案编号)。
a.容量瓶 b.玻璃棒 c.滴定管 d.烧杯
(4)滴定终点的判断依据是___________________________________________________。
(5)上述滴定中,滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用__________________________________________。滴定管液面变化如图所示,从图Ⅰ图Ⅱ显示消耗的高锰酸钾溶液体积为__________________。
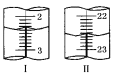
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)青蒿素结构如图,有关叙述正确的是_____(选填序号)。
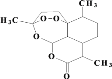
a.化学式为C15H21O5 b.不能与NaOH溶液反应
c.易溶于水 d.含有过氧键,有较强氧化性
由青蒿酸为原料出发,经五步合成可得到青蒿素,其中第2步为还原反应:
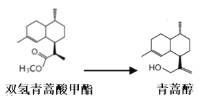
常温下即可反应且略放热,还原剂为LiAlH4。相关物质的性质:
物质 | 性质 |
双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂。 |
青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂。 |
乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点34.6℃。 |
氢化铝锂 | 固体,溶于乙醚。 与水反应:LiAlH4 + 4H2O →Al(OH)3↓+ LiOH +4H2↑ 可将一分子酯还原成二分子醇,自身生成醇铝、醇锂。 (醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇)。 |
某学习小组在实验室用双氢青蒿酸甲酯制取青蒿醇。
(2)反应中使用过量的氢化铝锂,理由是_____________________________________________。为使反应在溶液状态下进行,可用乙醚为溶剂,不用水的理由是____________________。
(3)请设计实验室制备装置(画出草图):____________
(4)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂。从反应混合物中提取青蒿醇的方法是:
①加_______后分液;
②从乙醚层提取青蒿醇。有多种方法,以下是二种方案:
方案一:蒸发结晶。 方案二:蒸馏析出晶体。
a.这2个方案在析出晶体后都应有残留液,原因是___________________________________。
b.请对这2个方案进行比较_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某大理石(含Fe2O3)转化为氯化钙水合物储热材料和高纯度的碳酸钙,无论从经济效益还是资源综合利用都具有重要意义。其工艺流程示意图如下。
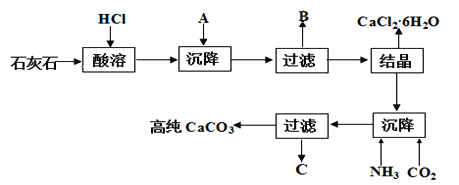
完成下列填空:
(1)上述流程中A是_________(填化学式,下同)、写出B中的成分___________。
(2)C可以作化肥,写出检验C中含有NH4+的方法:________。
(3)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是_____。
a 无毒
b 能导电
c 易溶于水
d 熔点较低(29℃熔化)
![]() CaCl2·6H2O
CaCl2·6H2O
(4)经过热重分析测得:CaCl2·6H2O在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示。则第一个相对稳定的物质的化学式是______。
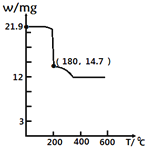
a CaCl2·4H2O
b CaCl2·2H2O
c CaCl2·H2O
d CaCl2
(5)工业还可以利用氨碱法的母液生产氯化钙。根据如图溶解度曲线,设计从含CaCl241%的饱和食盐水中,获得氯化钙水合物的流程______。
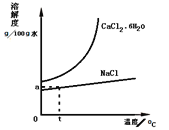
(流程示意:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
![]()
![]() A. ④①②⑤⑥③ B. ④①②⑥⑤③
A. ④①②⑤⑥③ B. ④①②⑥⑤③
![]()
![]() C. ①④②⑥③⑤ D. ①④②③⑥⑤
C. ①④②⑥③⑤ D. ①④②③⑥⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠有两种化合物,碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3),其中碳酸钠最为重要,在工业上有广泛的应用。在生活中,碳酸氢钠是常用的发酵剂的主要成分。完成下列计算:
(1)某天然碱的化学组成可能为aNa2CO3bNaHCO3cH2O(a、b、c为正整数),为了确定其成分:称取天然碱样品7.3g,充分加热后得到水的质量为0.9g,二氧化碳的质量为1.1g。该天然碱的化学式为____________。
(2)为了测定某发酵剂样品中碳酸氢钠的含量,取样品n克,充分灼烧以后,称的残留固体质量为m克(假设其他成分不分解)。则样品中碳酸氢钠的质量:_________(填含n、m的计算式)。
(3)已知酸性强弱顺序为:H2CO3 > HCO3- > HX。取由0.4molNaX、0.2molNa2CO3和0.1molNaHCO3组成的混合物,溶于200mL水中,往所得溶液中通入一定量的CO2气体,反应明显分两步,完成下列表格。
CO2(mol) | 0.05 | 0.15 | 0.6 |
NaX(mol) | ____ | ____ | ____ |
Na2CO3(mol) | ____ | ____ | ____ |
NaHCO3(mol) | ____ | ____ | ____ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com