
【题目】对于常温下的溶液,叙述正确的是( )
A.某氨水溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a<b
B.若1mL pH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
C.在滴有酚酞溶液的氨水里,加入盐酸至恰好呈无色,则此时溶液的pH=7
D.1.0×10-6mol/L盐酸的pH=6,1.0×10-8mol/L盐酸的pH=8
科目:高中化学 来源: 题型:
【题目】为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260 g草酸晶体,配成100 mL溶液。
②取25.00 mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000 mol/L的KMnO4溶液滴定H2C2O4溶液,当__________________时,滴定结束。
④记录数据,重复实验。整理数据如:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 11.50 |
回答下列问题:
(1)步骤①需使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为______________(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为_______________(填名称)。
(2)该反应原理的化学方程式为_____________________________________________。
(3)请将步骤③补充完整_____________________________________________________。
(4)根据数据,计算H2C2O4溶液的物质的量浓度为_________mol/L,x=________。
(5)若滴定终点读数时俯视KMnO4溶液液面,则x值会_________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,某烃分子的相对分子量为28,一定体积的该烃完全燃烧生成4.48LCO2和3.6g水,该烃的分子式_________________。
(2)顺-1,2-二溴乙烯结构式_________________。
(3)2-丁烯与HCl的加成方程式_______________________________________。
(4)![]() 的系统命名为________________。
的系统命名为________________。
(5)按要求回答下列问题:
合成芳香炔化合物的方法之一是在催化条件下,含炔氢的分子与溴苯发生反应,如:
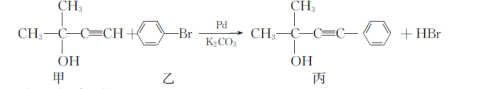
根据上式,请回答:
①丙能发生的反应是__________ (选填字母)。
a.取代反应 b.加成反应 c.水解反应 d.消去反应
②甲中含有的官能团名称为__________。
③符合下列条件的丙的同分异构体有__________种(不包括顺反异构)。
a分子中除苯环外不含其他环状结构;
b苯环上只有2个取代基,且其中一个是醛基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜生锈会生成铜绿[Cu2(OH)2CO3],铜绿受热易分解,化学方程式为:Cu2(OH)2CO3 ![]() 2CuO+H2O+CO2↑。
2CuO+H2O+CO2↑。
(1)部分锈蚀成铜绿的铜片隔绝空气加热,完全反应后固体质量减少了9.3g,则生锈的铜片中铜绿的质量为___________g
(2)将35g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液PH值为1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到39.2g蓝色固体。(假设反应前后溶液的体积不变)
①已锈蚀的铜片中的铜元素的质量分数为________。(保留两位小数)
②铜片中单质铜的物质的量为________mol。
(3)若生成NO2和NO混合气体共a L(S.P.T)。
①求a的取值范围(写出详细解答过程)________。
②求原硝酸的物质的量浓度(用含a的代数式表示,写出详细解答过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物合成中间体F制备路线如下:
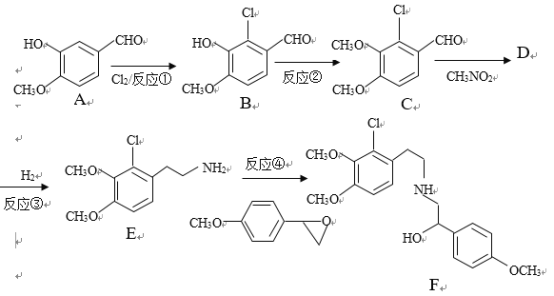
已知:RCHO+R’CH2NO2![]()
 +H2O
+H2O
(1)有机物A结构中含氧官能团的名称是__________________.
(2)反应②中除B外,还需要的反应物和反应条件是___________________
(3)有机物D的结构简式为_____________________,反应③中1摩尔D需要___摩尔H2才能转化为E
(4)反应④的反应物![]() 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式_____________。
a.结构中含4种化学环境不同的氢原子
b.能发生银镜反应
c.能和氢氧化钠溶液反应
(5)已知:苯环上的羧基为间位定位基,如![]()
![]()
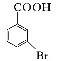 。写出以
。写出以![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选)_____________。
的合成路线流程图(无机试剂任选)_____________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )
pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数[φ(B)]的关系曲线,由曲线分析,下列判断正确的是( )
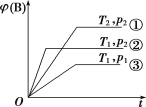
A.T1<T2,p1>p2,m+n>p,放热反应
B.T1<T2,p1>p2,m+n<p,吸热反应
C.T1>T2,p1<p2,m+n<p,吸热反应
D.T1>T2,p1<p2,m+n>p,放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型化学实验可以有效实现化学实验绿色化的要求。如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好。根据上述描述涉及到的元素,回答问题:
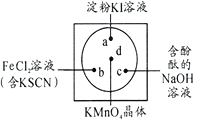
(1)KMnO4中Mn元素的化合价为:_______________,Fe在周期表中的位置是:_____________________。
(2)第三周期原子半径最小的原子共有______ 种不同能量的电子;长周期主族元素形成化合物的电子式为:__________________。
(3)结合已学知识分析a、c处的可能出现的现象:a:_____________________________;c:_________________________________;b处可能发生反应的离子方程式:___________________________________________________________
(4)已知溶液中,还原性为HSO3>I-,氧化性为IO3>I2>SO42.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示:
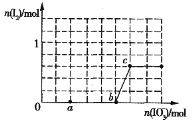
①a点处的还原产物是:____________(填离子符号); b点→c点反应的离子方程式是:_________________________________________
②当溶液中的I-为0.5mol时,加入的KIO3可能是:____________________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳原子2p亚层上的2个电子不相同的方面是____(选填序号)。
a.能量 b.电子云形状 c.电子云伸展方向 d.自旋状态
14N 原子与12C原子比,质子数和中子数都更多,但原子半径却更小,请解释__________________。
(2)铍(Be)与铝性质相似。
①以下对铍及其化合物的推断肯定不正确的是______(选填序号)。
a.铍会在浓硫酸中钝化 b.氯化铍固体会发生升华现象
c.氧化铍坚硬难熔 d.铍的熔点低于镁
②写出BeCl2溶液和Na2BeO2溶液混合后反应的离子方程式____________________________。
(3)将BeCl2溶液加热蒸干后灼热,再使其熔融,用直流电电解,可得到单质铍和一种单质气体,则该气体的化学式为_______。
(4)氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:
2Al2O3(s)![]() 4Al(g)+3O2(g) ①
4Al(g)+3O2(g) ①
2C(s)+ O2(g)![]() 2CO(g) ②
2CO(g) ②
2Al(g)+N2(g)![]() 2AlN(s) ③
2AlN(s) ③
试分析反应②对制备AlN的作用______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各关系式中能说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com