
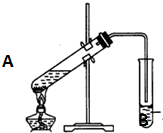
 实验室用一定比例的乙醇、乙酸和浓硫酸的混合液制备乙酸乙酯,装置如图所示:
实验室用一定比例的乙醇、乙酸和浓硫酸的混合液制备乙酸乙酯,装置如图所示:| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1所示装置,检验碳酸钾中钾元素的存在 |
| B、图2所示装置,称量少量氢氧化钠固体 |
| C、图3所示装置,分离CCl4萃取溴水后所得的有机层和水层 |
| D、图4所示装置,分离沸点相差较大的酒精、水的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中(放有等质量的纸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体中一定没有乙炔 |
| B、混合气体中一定有乙烯 |
| C、混合气体可能由乙炔和丙烯组成 |
| D、混合气体可能由丙烯和丙炔组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在由水电离产生的氢离子浓度为10-13 mol?L-1的溶液中,Ca2+、K+、Cl-、HCO3-四种离子能大量共存 |
| B、已知MgCO3的Ksp═6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)═6.82×10-6 |
| C、对于反应2N2H4(l)=N2(g)+2H2(g)△H=-50.6 kJ?mol-1,它只在高温下自发进行 |
| D、常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com