
����Ŀ��������12�֣�
��.ij����ˮ�к�KCN����Ũ��Ϊ0.01mol��L-1���������������������������·�Ӧ(��������N���ϼ۾�Ϊ-3��)��
��1��KCN+2KOH+Cl2��KOCN+2KCl+H2O��������Ԫ����______________��(��Ԫ�ط��ű�ʾ)
��2��Ͷ�����Һ�ȣ��ɽ������ν�һ������Ϊ����������ƽ���л�ѧ����ʽ��
![]()
��3������10 L��KCN��Ũ��Ϊ0.01mol�� L-1�ķ�ˮ��KCN������ȥ��������Ҫ����_______mol��
��.ijʵ��С��Ϊ�˲ⶨ��3������Һ����Cl2�ĺ���������Na2S2O3����Һ���ж����ⶨ��
��4����ʵ��������480mLһ��Ũ�ȵ�Na2S2O3��Һ�����Ƹ���Һ���貣���������ձ�����Ͳ������������ͷ�ι��⣬���� ��
��5��Na2S2O3��ԭ�Խ�ǿ������Һ���ױ�Cl2������SO42�������Na2S2O3���������ȼ����÷�Ӧ�����ӷ���ʽΪ ��
��6����ȡ��3������Һ20.00mL����a mol��L-1 Na2S2O3��Һ���еζ�������ƽ��ʵ��������Na2S2O3����Һb mL�������Һ��Cl2��Ũ��Ϊ mol��L-1 (�ú�a ��b�ı���ʽ��ʾ) ��
���𰸡���1��C��2��2KOCN+3Cl2 +8KOH��2K2CO3+N2+6KCl+4H2O��3��0.25
��4��500mL����ƿ����5��S2O32��+4Cl2+5H2O��2SO42��+8Cl��+10H+
��S2O32��+4Cl2+10OH����2SO42��+8Cl��+5H2O����6��0.2ab��ab/5
��������
�����������.��1����ӦKCN+2KOH+Cl2��KOCN+2KCl+H2O��Ԫ�ػ��ϼ۽��ͣ�����ԭ��̼Ԫ�ػ��ϼ۴ӣ�2�����ߵ���4�ۣ�ʧȥ���ӣ���˱�������Ԫ����C��
��2����Ԫ�صĻ��ϼ۴�0�۽��͵���1�ۣ��õ�1�����ӡ���Ԫ�ػ��ϼ۴ӣ�3�����ߵ�0�ۣ�ʧȥ3 �����ӣ���˸��ݵ��ӵ�ʧ�غ��֪�������ͻ�ԭ�������ʵ���֮����3��2������ԭ���غ��֪����ˮ���ɣ���˷�Ӧ�ķ���ʽΪ2KOCN+3Cl2 +8KOH��2K2CO3+N2+6KCl+4H2O��
��3���������Ϸ�����֪1molNaCN���ձ�����Ϊ̼��غ͵�����ʧȥ5mol���ӣ�1�����õ�2mol���ӣ����ݵ��ӵ�ʧ�غ��֪��10 L��KCN��Ũ��Ϊ0.01mol�� L-1�ķ�ˮ��KCN������ȥ��������Ҫ����![]() ��0.25mol��
��0.25mol��
��.��4��û��480mL����ƿ����������500mL����ƿ��
��5��Na2S2O3��ԭ�Խ�ǿ������Һ���ױ�Cl2������SO42�����÷�Ӧ�����ӷ���ʽΪS2O32��+4Cl2+5H2O��2SO42��+8Cl��+10H+��
��6������Na2S2O3�����ʵ�����0.001abmol�����ݷ���ʽ��֪����������0.004abmol����˷�Һ��Cl2��Ũ��Ϊ0.004abmol��0.02L��0.2abmol��L-1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ƚ����и����е�ǰ�ߺͺ��ߣ�����>������<������=�����
��1���е㣺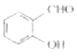
![]()
��2����ˮ�е��ܽ�ȣ�CH3CH2OHCH3(CH3)2CH2OH
��3�����ԣ�HClO3HClO4
��4��������H-OH-S
��5��δ�ɶԵ�������OCr
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����C1��ѧ����ָ��̼���ʻ��������1��̼ԭ�ӵ���������CO��CO2��CH4��CH3OH����Ϊԭ�Ϻϳɹ�ҵ��Ʒ����ѧ���գ��Կ�������Դ�Ϳ��ƻ�����Ⱦ����Ҫ���塣
��1��һ���¶��£��������ݻ���Ϊ2 L���ܱ����������ֱ�����Ӧ��
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H=��49.0kJ/mol������������£�
CH3OH(g)+H2O(g) ��H=��49.0kJ/mol������������£�
���� | �� | �� |
��Ӧ��Ͷ���� | 1 mol CO2(g)��3 mol H2(g) | 1 mol CH3OH(g)��1 mol H2O(g) |
ƽ��ʱc(CH3OH) | c1 | c2 |
ƽ��ʱ�����仯 | �ų�29.4 kJ | ����a kJ |
��ش�
��c1 c2������>������<������=������a = ��
����������Ӧ10 sʱ�ﵽƽ�⣬����CO2����ʾ���з�Ӧ�ӿ�ʼ��ƽ������е�ƽ����Ӧ������ mol/(L��s)��
��2��ѹǿΪp1ʱ �������Ϊ1 L���ܱ������г���b mol CO��2b mol H2��������ӦCO(g)+2H2(g)![]() CH3OH(g)��ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����ش�
CH3OH(g)��ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ����ش�

���÷�Ӧ���� ��������š����ȷ�Ӧ��p1 p2�����������������������
��100��ʱ���÷�Ӧ��ƽ�ⳣ��K= ���ú�b�Ĵ���ʽ��ʾ����
��3����������β������Ӧ��2NO(g)+2CO(g)2CO2(g)+N2(g) ��H<0���ں��º��ݵ��ܱ�������ͨ��n(NO):n(CO)=1:2�Ļ�����壬����������Ӧ������ͼ����ȷ����˵����Ӧ�ڽ��е�t1ʱ��һ���ﵽƽ��״̬���� ��ѡ����ĸ����


![]()

a b c d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(BCl3)��һ����Ҫ�Ļ���ԭ�ϣ���������ȡ������(B2H6)��Ҳ�����л��ϳɴ�����ij��ȤС����ѡ������װ���Ʊ�BCl3(��֪BCl3�ķе�Ϊ12.5 �����۵�Ϊ��107.3 ����2B��6HCl![]() 2BCl3����3H2����
2BCl3����3H2����

��ش��������⣺
��1��װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2���������������Ӹ�װ�õĽӿڣ�˳��Ϊa-( )- ( )- ( )- ( )- ( )-( )-f-g-h�����Ӻ�װ�ú��ʵ�������__________________________��
��3��װ��D�������� ��ʵ����������װ��C�����ܲ�����Σ���� ��
��4��BCl3��ˮ����ˮ��۲쵽�����İ��������������ᣬ�䷴Ӧ�Ļ�ѧ����ʽΪ��_____________��
��5��װ��E�����ó��˿������ն���Cl2�⣬����������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¶��£�ˮ��Һ��H+��OH-��Ũ�ȱ仯������ͼ������˵����ȷ���ǣ� ��

A. �����¶ȣ�����������c��b�ı仯
B. ���¶��£�ˮ�����ӻ�����Ϊl.0��10-13
C. ���¶��£�����FeCl3����������b��a�ı仯
D. ���¶��£�ϡ����Һ����������c��d�ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ֲ�����ڶ��е����ǣ� ��
A. �����ǡ����Ǻ��������� B. ���Ǻ���ѿ��
C. ��ԭ����ά�� D. ����ԭ�ͼ���ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��4NH3(g)+5O2(g) ![]() 4NO(g)+6H20(g) ��H����1025 kJ��mol��1������Ӧ����ʼ���ʵ�����ͬ�����й��ڸ÷�Ӧ��ʾ��ͼ����ȷ����
4NO(g)+6H20(g) ��H����1025 kJ��mol��1������Ӧ����ʼ���ʵ�����ͬ�����й��ڸ÷�Ӧ��ʾ��ͼ����ȷ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ʵ�����Ʊ��������������ᶡ����������ȷ����
A. ������ˮԡ���� B. �Ʊ����ᶡ��ʱ����������
C. �����ñ߷�Ӧ������ķ��� D. �Ʊ���������ʱ�Ҵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��10����100��ʱ��pH��ǰ�ߺͺ��ߵĹ�ϵ��
A. ǰ�ߴ� B. ǰ��С C. ��� D. ����ȷ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com