
【题目】比较下列各项中的前者和后者,用“>”、“<”、或“=”填空
(1)沸点: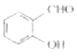
![]()
(2)在水中的溶解度:CH3CH2OHCH3(CH3)2CH2OH
(3)酸性:HClO3HClO4
(4)键长:H-OH-S
(5)未成对电子数:OCr
【答案】(1)<(2)>(3)<(4)<(5)<
【解析】
试题分析:
(1)邻羟基苯甲醛分子内能形成氢键,使沸点降低;对羟基苯甲醛分子间能形成氢键,使沸点升高,则有邻羟基苯甲醛沸点小于对羟基苯甲醛沸点。
(2)羟基为亲水基团,烷基为憎水基团,则烷基所含碳数越多,水溶性越差,故有CH3CH2OH在水中的溶解度大于CH3(CH3)2CH2OH在水中的溶解度。
(3)同一元素所形成的含氧酸,价态越低,酸性越弱,则有HClO3的酸性小于HClO4的酸性。
(4)原子半径越小,共价键键长越短,则有H-O的键长小于H-S的键长。
(5)O的电子排布式为1s22s22p4,含有2个未成对电子。Cr的电子排布式为1s22s22p63s23p63d54s1,含有6个未成对电子。所以未成对电子数:O<Cr。


科目:高中化学 来源: 题型:
【题目】13.0 g Zn与200 mL 1.5 mol·L-1 H2SO4溶液充分反应后,所得溶液中的溶质是______________(填化学式),其中阳离子的物质的量浓度为____________(忽略反应前后溶液体积变化);实验室用氯酸钾和二氧化锰制氧气,______________元素被还原,当有224 mL(标准状况下)O2生成时,电子转移的数目为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,能证明醋酸是弱电解质的是
A. 水溶液的导电能力很弱 B. 溶液中已电离出的离子和未电离的分子共存
C. 能和氢氧化钠溶液反应 D. 熔化状态时不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,1 mol/L醋酸加水稀释至0.01 mol/L,关于稀释前后的下列变化正确的是
A.溶液中c(OH-)减小 B. pH的变化值等于2
C.溶液中![]() 的值增大 D. Kw的值减小
的值增大 D. Kw的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成细胞的微量元素的说法,不正确的是( )
A. 通常指生物生活所必需的,但需要量却很少的一些元素
B. 生物体中可以有,也可以没有的一些元素
C. 微量元素是细胞维持正常生命活动不可缺少的元素
D. Cu、Zn、Mo等元素是细胞内的微量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.124gP4含有的P-P键数为4NA(设NA表示阿伏伽德罗常数的值)
B.Be和NaOH溶液反应的离子方程式是:2Be+2OH-+2H2O=2BeO2-+3H2↑
C.在NaCl溶液中加入AgNO3溶液,生成白色沉淀;在加入氨水,沉淀消失。沉淀消失发生的离子方程式是:AgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O
D.0.1mol/L的Fe3+溶液中,能大量共存的离子有Cl-、SO42-SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将1 mol Cl2通入到含1 mol FeI2溶液中: 2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-=HClO+HSO | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合: 2AlO | 正确;AlO |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
H2O(g)=H2(g)+1/2O2(g) △H=+241.8kJ/mol
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
当1g水蒸气变为液态水时,其热量变化是
A.放热2.44kJ B.吸热2.44kJ C.放热44kJ D.吸热44kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题12分)
Ⅰ.某厂废水中含KCN,其浓度为0.01mol·L-1,现用氯氧化法处理,发生如下反应(化合物中N化合价均为-3价):
(1)KCN+2KOH+Cl2=KOCN+2KCl+H2O被氧化的元素是______________。(用元素符号表示)
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
![]()
(3)若将10 L含KCN的浓度为0.01mol· L-1的废水中KCN氧化除去,最少需要氯气_______mol。
Ⅱ.某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定。
(4)现实验室需用480mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需 。
(5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42﹣,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为 。
(6)现取(3)中溶液20.00mL,用a mol·L-1 Na2S2O3溶液进行滴定,经过平行实验测得消耗Na2S2O3标准溶液b mL,计算废液中Cl2的浓度为 mol·L-1 (用含a 、b的表达式表示) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com