
【题目】能正确表示下列反应的离子反应方程式为( )
A.NH4HCO3溶于少量的浓KOH溶液中:NH4++ HCO3-+2OH-= CO32-+ NH3↑+2 H2O
B.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-![]() 3Fe3++NO↑+3H2O
3Fe3++NO↑+3H2O
C.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2
D.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO![]() ===BaSO4↓+H2O
===BaSO4↓+H2O
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)4C(g)+6D(g) 在5L的密闭容器中进行反应,30min后,C的物质的量增加了0.30mol.下列叙述正确的是( )
A.30min中A的平均反应速率是0.010molL﹣1min﹣1
B.容器中D的物质的量一定增加了0.45mol
C.容器中A,B,C,D的物质的量的比一定是4:5:4:6
D.容器中A的物质的量一定增加0.30mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组的同学想通过下图实验装置探究SO2与Na2O2反应的产物。(夹持装置已略去,装置的气密性良好)
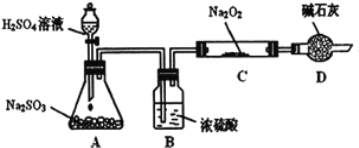
Ⅰ.实验中装置B可吸收水分,干燥SO2气体,其目的是:________________。装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是:_______。
Ⅱ.对C中固体产物提出如下假设:(假设Na2O2已全部反应)
假设1:__________。
假设2:只有Na2SO4; 假设3:既有Na2SO3又有Na2SO4。
(1)甲同学认为SO2与Na2O2的反应不同于CO2,应为假设2成立,请据此写出C中所发生反应的化学方程式:_____________________。
(2)若假设2成立,为确定C中固体产物的成分,甲同学设计如下实验:
![]()
得出结论:C中固体产物只有Na2SO4。该方案是否合理?答:__________。(填“是”或“否”)理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.5gNaHCO3、Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中错误的是
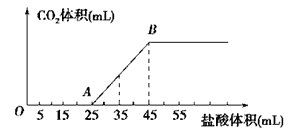
A. OA段发生反应的离子方程式为:OH-+H+==H2O H++CO32-==HCO3-
B. 当加入35mL盐酸时,产生CO2的体积为336mL
C. 混合物中NaOH的质量0.6g
D. A点溶液中的溶质为NaCl、NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤I 中发生反应的化学方程式为___________、___________ 。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因: ___________ 。
(3)步骤Ⅲ获得CuSO4 溶液的离子方程式为___________ 。
(4)步骤II 所得滤液经进一步处理可制得Na2FeO4,流程如下:
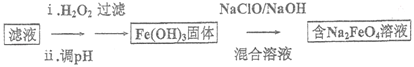
①测得滤液中c(Fe2+)为a mol/L,若要处理1m3滤液,理论上需要消耗25%的H2O2溶液___________kg(用含a 的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式: ___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
A.33%
B.40%
C.50%
D.65%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3) 是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1) 工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3 ↓+ (NH4)2SO4+CO2 ↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4。加入稍过量的NH4HCO3的目的是_____。
(2) 实验室模拟工业二氧化锰制备硫酸锰装置如图4所示。

①石灰乳的作用是________。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有________。
(3) MnCO3 在空气中加热易转化为不同价态的锰的氧化物,且其固体残留率随温度的变化如图5 中A、B、C、D 点所示。则300℃时,剩余固体中锰元素与氧元素的物质的量之比即n(Mn) :n(O)为_______; 图中点D 对应固体的成分为______ (填化学式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com